-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
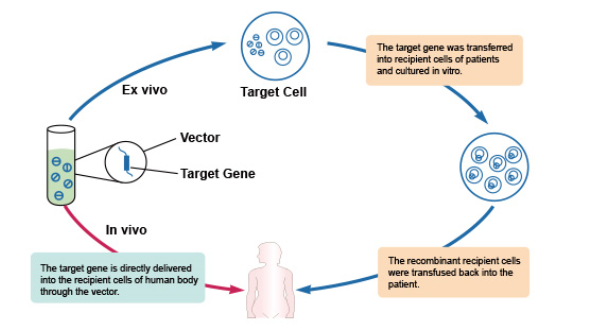
遺伝子治療とは、遺伝子発現の修正または操作、あるいは生細胞の生物学的特徴の改変により、疾患の治療または治癒という目的を実現するための技術となります。遺伝子改変の発生タイミングに基づき、遺伝子治療の経路は一般的に、体外(ex vivo)と体内(in vivo) の二種類に分けられています。体外は、体外で培養細胞の遺伝子を修復することにより、修復後の細胞を人体に注入するのに対し、体内は、遺伝子改変ができる物質をベクターで直接に人体に注入します。
現在、遺伝子治療製品は、ガン、遺伝病と感染症を含む一連の疾患の治療に使用されています。遺伝子治療の発展は、ヒト疾患の治療に対し、確実な希望をもたらしています。ただし、治療方法を本格にヒトに応用する前に、大量な臨床前科学研究により基礎を筑く必要があります。その内、体内動物モデルの構築、ベクターの選択、治療方針の確定等が含まれています。
本文では、遺伝子治療の作用機序に基づき、動物モデルとウィルスベクターの遺伝子治療における研究事例に合わせ、この課題を研究している学者たちに更なる考え方と視点を提供します。
1. 遺伝子治療-体内動物モデルの構築
ヒト疾患動物モデルは、生物医学科学研究において構築され、ヒト疾患模擬発見を有する動物試験対象と材料になります。動物モデルは、現代生物医学研究において極めて重要な試験方法と手段であり、より便利に、有効にヒト疾患の発生、進行を認識し、予防治療対策を研究することに役立ちます。現在、遺伝子治療のリスクには、重度の免疫反応(例えばサイトカインストーム)、神経毒性、挿入突然変異(発がん性)が含まれ、そのうち、重度の免疫反応はよく見られ、短期間で患者の命にかかわる副作用になります。遺伝子治療における重度の免疫反応の発生を減少するために、試験動物モデルの選択は重要なことになります。
遺伝子編集技術により構築された動物モデルは、ヒト体内の生理、病理環境をよく模擬するとともに、一部疾患の病理変化も模擬することができるため、疾患の発生過程との一致性が高いです。臨床前研究において、動物モデルの全体レベルに基づき遺伝子治療試験を実施することにより、遺伝子治療プランの実行可能性、有効性、安全性および免疫反応に対し評価し、臨床試験の安全性と信頼性を大幅に向上することができます。
もちらん、臨床前の動物研究において遺伝子編集モデルの選択は、疾患の種類により考慮する必要があります。遺伝子欠失または不活化による疾患について、最も適合するのは、遺伝子が同様に突然変異した点突然変異またはヒト化マウスになりますが、遺伝子ノックアウトまたは条件付きノックアウト(KO/cKO)マウスにも大きな研究価値があります。その原因は、マウスにおける点突然変異がヒトと同じような遺伝子機能完全欠失を引き起こさず、ノックアウトにより関連の疾患表現型が得られる必要があるからです。
2. モデル構築-遺伝子編集技術に基づく
現在、遺伝子編集は、遺伝子治療において研究熱度が最も高く、応用見込みが最も広い技術です。この技術は、遺伝子編集ツールCRISPR、転写活性化因子様エフェクターヌクレアーゼ(TALEN) またはジンクフィンガーヌクレアーゼ(ZFN)を使用し、修復遺伝子を部位特異的に細胞のDNAに挿入することにより、遺伝子の無作為挿入によるリスクを回避するとともに、修復または挿入により治療効果の持続可能性を保証できます。
遺伝子編集技術の発展に伴い、その編集効率と正確性も向上し、応用分野も広がりつつあります。一方では、発現調節と遺伝子機能に対する研究、細胞動物モデルの構築、ガン遺伝子と薬剤標的のスクリーニングに使用できます;また一方では、遺伝子治療において更なる巨大な発展見込みがあります‐遺伝子治療は、主に正常な遺伝子または編集により欠失が修復された遺伝子を導入することにより、疾患治療の目的を果たしています。現在、遺伝子編集技術は既に数多くの疾患、例えば単一遺伝子遺伝性疾患、眼科疾患、エイズおよび腫瘍等の遺伝子治療において応用されています。
2.1 遺伝子治療-ウィルスベクターの選択
ウィルスベクターとは、ウィルスを基にする遺伝子ベクターのことです。具体的な調製過程は、ウィルスゲノムを操作と改造し、外来遺伝子と関連遺伝子エレメントを繋ぎ合わせ、ウィルスプラスミドに包装します。外来遺伝子を携帯するウィルスベクターはウィルスプラスミドに包装され、遺伝子導入システム(gene delivery system)に構成されます。大半数の野生型ウィルスは、人体に対し病原性があるため、改造してから人体に使用することができるようになります。ウィルスの多様性および人体との複雑な依存関係により、多くのウィルスの生活環、分子生物学的特徴、疾患の発生と進行との関係等に対する認識がまだ不十分であるため、多くのウィルスが実用性のあるベクターへ発展するのは制限されています。
直近20年間で、レトロウイルス(HIVウィルスを含む)、レンチウイルス(lentivirus)、アデノウイルス(adenovirus)、アデノ随伴ウイルス(adeno-associated virus, AAV)、ヘルペスウイルス(単純ヘルペスウイルス、ワクシニアウイルスおよびEBウィルスを含む)などのわずかなウィルスは遺伝子転移ベクターによく改造され、一定程度の応用が開始しています。
|
ウィルス種類 |
メリット |
デメリット |
|
レトロウイルス、 レンチウイルス |
|
|
|
アデノウイルス |
|
|
|
アデノ随伴ウイルス |
|
|
Table 1- 常用遺伝子ベクターの比較
- レトロウイルス、レンチウイルス:この二種類のウィルスは、遺伝子をヒト細胞のDNAに正しく挿入することができます。ただし、この挿入では、ランダム性が高いため、その他正常遺伝子に挿入されると、その遺伝子が不活化となり、更にガンになります。
- アデノウイルス(adenovirus):アデノウイルスウィルスは、遺伝子をヒト細胞のDNAに挿入することでなく、ベクター自体により携帯した正確遺伝子をヒト細胞で発現するため、安全です。ただし、アデノウイルスは強い免疫反応を引き起こします。
- アデノ随伴ウイルス(AAV):アデノ随伴ウイルスベクターは、一般的に遺伝子フラグメントをヒト細胞のDNAに挿入せず、引き起こした免疫反応も比較的に低いです。そのため、AAVは現在遺伝子治療において使用されている主なベクターです。
3. 事例分析
下記は動物モデルとウィルスベクターの遺伝子治療における研究事例の概要になります:
3.1 遺伝子編集による家族性高コレステロール血症の治療
中国科学院生物化学・細胞生物学研究所の周斌課題組と交通大学国際母子保健センターの黄荷鳳チームは、Circulation雑誌で「In Vivo AAV-CRISPR/Cas9-mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia」と題する文章を発表しました。AAV-CRISPR/Cas9システムのLdlr突然変異を携帯するマウス(サイヤジェンによって構築された)に対するLDLR遺伝子修復がLDLR発見を一部修復し、LDLR突然変異体におけるアテローム性動脈硬化を有効に改善できることが分かったため、家族性高コレステロール血症患者の治療に潜在的な治療方法を提供しました【1】。
家族性高コレステロール血症(FH)は、よくある遺伝性脂質異常症であり、臨床症状として、血液中のコレステロールレベルが明らかに高くなり、早期心血管疾患(例えば心筋梗塞、中風)等に至り、重度の場合に命に危害が及びます。FHの最もよくある(>90%)遺伝子欠失は、低比重リポタンパク質受容体LDLR遺伝子突然変異のエンコードによるものであり、LDLRタンパク質の喪失で、循環系において低比重リポタンパク質LDLが堆積することになります。ヘテロ接合体のLDLR活性が2~25%であり、一般的にスタチン類薬剤で治療するのに対して、ホモ接合体のLDLR活性が2%以下であり、薬剤治療による反応がなく、乳幼児時期から重度のアテローム性動脈硬化表現型および各種の併発症が発生することがあります。ホモ接合体FHについて、現時点の治療手段にはLDL血漿交換および肝移植等がありますが、費用が高く、一定のリスクがあるため、新しい治療方法を継続して探し、探索するのに重要な意味があります。
AAV-CRISPR/Cas9システムでLdlrE208Xマウス体内において遺伝子編集を実施することにより、一部肝細胞のLdlr突然変異を修復し、そのうち一部のLDLRタンパク質発見も回復することができました。研究者は対照群と比較すると、一部のLDLRタンパク質発見が回復しても、高脂肪食の誘導により、対照群と比べ、治療群LdlrE208Xマウスのアテローム性動脈硬化症状が明らかに改善され、マクロファージの浸潤、脂質の積重等の症状も明らかに軽減し、循環系に関する各指標も明らかに改善できたことを発現しました。同時に、研究者はCRISPR/Cas9システムのオフターゲット効果および一部の免疫指標を測定した結果、成体マウスの体内にて明らかなオフターゲットおよび免疫拒絶反応がなかったため、今回遺伝子編集治療の有効性と安全性を証明できました。
この研究では、CRISPR/Cas9システムで家族性高コレステロール血症の病原遺伝子を標的・修正することにより、アテローム性動脈硬化等の関連表現型が改善できることが明らかになりました。将来、AAVが提供するCRISPR/Cas9システムは、遺伝性心血管疾患における一部の体細胞遺伝子突然変異を修復することにより、疾患を改善し、更に修復することができるようになります。
3.2 遺伝子治療による神経変性疾患の研究
アルツハイマー病(Alzheimer's disease,AD)は、進行性の神経変性疾患であり、臨床で記憶や認知機能障害、言語や行動能力が現れ、後期に重度の記憶喪失症状と運動能力が患者に現れ、最終的に死亡となります。
アミロイドβタンパク質は脳にあるアミロイド斑の主な成分であり、アルツハイマー病患者の脳にあるアミロイド斑の積重ねは患者の脳細胞死亡を誘発することができます。これも遺伝子治療の有効な策略を開いています。例えば、ウィルスベクターを有するCRISPR/Cas9は、異常タンパク質の発生を改変することにより、異常タンパク質の積重ねを制限します。多くのAD遺伝的感受要素、例えばアポリポタンパク質E(APOE)とプレセニリン(PSEN)は、既にAD発展の重要な構成要素と分類され、CRISPR/Cas9システムに潜在的な標的を開いています。
スウェーデンウプサラ大学のMartin Ingelsson氏および同僚は、CRISPR/Cas9で患者細胞とマウスアミロイドβ前駆体タンパク質を修正する初めてのスウェーデン型突然変異(APPswe)の研究成果を発表し、早発性常染色体優性遺伝アルツハイマー病(AD)の治療に使用されています。突然変異したAPPsweのノックアウトにより、患者細胞にあるAβの発生を減少するとともに、野生型対立遺伝子を完全に維持させます。同じ策略を通して、彼らはヒトAPPswe対立遺伝子を保有するトランスジェニックマウスのゲノムを修正しましたが、AD病理に影響を与えるかどうかはまだ明らかになっていません。この研究成果によると、早発性AD症例は、APPsweの破壊により利益を受ける可能性があります。【2】
現在、アルツハイマー病の治療は、最も基礎となる発病分子機序などの沢山の障害に直面しており、把握できたものが不足しています。ただし、これは決して不可能という意味でなく、さんざん挫折に遭ってきたAD治療分野において、遺伝子治療がまだ新有望株として、無数の可能性があります。
4. サイヤジェン遺伝子治療ワンステーションソリューション
サイヤジェンは、お客様に遺伝子治療に関する動物モデル、およびウィルスベクターを提供し、多くの科学研究者に便利なサービスを提供しています:
- 動物モデルの構築と選択
|
サービス |
内容 |
|
ノックアウトマウスライブラリ |
|
|
カスタムマウス·ラットモデル |
|
|
サイヤジェン腫瘍モデルと薬効評価プラットフォーム |
|
|
動物モデルサポートサービス |
- ウィルスベクター
また、サイヤジェンが提供するレンチウイルス、アデノウイルス、アデノ随伴ウイルスの包装サービスは、ウィルス力価、純度、活性等においてウィルス包装品質の信頼性が確保され、各細胞モデルの構築、生体動物への体内注射、遺伝子治療などの研究分野に幅広く応用されています。
まとめ:
疾患のメカニズムと有効な治療標的に対する継続的な認識、および遺伝子編集技術のアップグレードと発展に伴い、遺伝子編集による治療プランの大規模な臨床応用は可能となり、特に従来通り治療方法で治癒し難しい疾患、例えば希少疾患、遺伝性疾患等です。遺伝子編集により病原遺伝子を修正し、または有益な突然変異を導入することで、疾患の治癒を実現することができます。遺伝子編集技術の臨床への転換および応用に関する研究は、将来遺伝子治療の幅広い応用と研究の鍵となります。
サイヤジェンは、お客様にモデル構築からウィルスベクター包装・構築まで遺伝子治療研究に関するワンステーションソリューションをご提供いたしますので、お問い合わせとご注文をお待ちしております。
References:
- H Zhao, Y Li, L He, W Pu, W Yu, Y Li, YT Wu, C Xu, Y Wei, et al. In Vivo AAV-CRISPR/Cas9–Mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia. Circulation. 2020;141:67-79 DOI: 10.1161/CIRCULATIONAHA.119.042476
- György B, Lööv C, Zaborowski MP, Takeda S, et al. CRISPR/Cas9 Mediated Disruption of the Swedish APP Allele as a Therapeutic Approach for Early-Onset Alzheimer's Disease. Mol Ther Nucleic Acids. 2018;11:429-440. DOI: 10.1016/j.omtn.2018.03.007
サイヤジェン株式会社について
サイヤジェン株式会社は15年間の発展を経て、全世界の数万人の科学研究者にサービスを提供しており、製品と技術は直接にCNS (Cell、Nature、Science)の定期刊を含む5,200余りの学術論文に応用されています。弊社の「ノックアウトマウスライブラリ」は低価格だけでなく、遺伝子名称を入力すれば、ワンクリックで注文まで操作できます。 ノックアウトマウス、ノックインマウス、コンディショナルノックアウトマウス、トランスジェニックマウス、GFPマウス、免疫不全マウス、無菌マウスなどのカスタマイズサービスを提供する以外、専門的な手術疾患モデルチームがあり、多種の複雑な小動物手術疾患モデルも提供できます。
