-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
CAR T細胞療法研究は、血液悪性腫瘍におけるCAR T療法の顕著な有効性に基づき、近年急速に発展しており、科学者たちによって、この革新的な免疫療法を肉腫、癌、リンパ腫などの固形腫瘍の治療に適用する動きが加速しています。ここでは、固形腫瘍治療におけるCAR T細胞療法の背景、共通の研究標的、CAR T最適化戦略、および臨床研究の進展について概説します。
CAR T療法の研究背景
キメラ抗原受容体T(CAR T)細胞療法とは、遺伝子工学的に改変されたT細胞が、腫瘍細胞の表面にある特定の抗原を認識し、様々な免疫因子を放出することで腫瘍細胞を死滅させる治療法です。CAR T細胞療法の開発には、遺伝子組換え技術により、腫瘍特異的抗原認識ドメインとT細胞活性化シグナルを持つ遺伝子をT細胞に導入することが必要です。
近年、固形腫瘍抗原を標的としたCAR T療法の臨床試験が増加しています。ClinicalTrials.govが提供するデータによると、2022年4月時点で進行中の細胞ベースの臨床試験は1,800件で、昨年と比較して33%増加しています。これらの細胞ベースの臨床試験のうち、固形腫瘍を対象としたものは43%を占め、昨年比44%増となり、血液悪性腫瘍の増加率を実質的に上回っています(2021年比25%増程度に留まる)。昨年、固形腫瘍に対するCAR T療法は、血液悪性腫瘍に対するものよりも急速に発展しており、CAR T細胞療法アプローチの可能性が高まっていることを示してします。
固形腫瘍治療のためのCAR T療法の共通標的
近年、様々な固形腫瘍抗原を標的としたCAR T研究が徐々に増加し、かなりの数が臨床試験の初期段階に入っています。
- 例えば、ガングリオシド2(GD2)を標的としたCAR T療法は、神経芽腫において顕著な有効性を示しました。
- グリピカン3(GPC3)を標的とするCAR T細胞は、肝細胞がん(HCC)の治療において良好な結果が得られました。
- ヒト上皮増殖因子受容体2(HER2)は、胃がんや膵臓がんなど様々な腫瘍組織で高発現しており、この標的に設計したCAR T細胞は、進行した胆道がんや膵臓がんを治療することができます。
- メソセリン(MSLN)もまた、免疫療法の標的として人気のある研究対象です。膜表面に固定されたこの糖タンパク質は、さまざまな腫瘍で高発現しており、腫瘍の増殖、浸潤、予後不良に密接に関係しています。MSLNを標的としたCAR T細胞の第I相臨床試験の結果、治療した膵臓がんの患者において有意な有効性が示されました。
- 胃特異的な膜タンパク質であるクローディン(Claudin18.2、CLDN18.2)は、胃がんなどの治療標的として有望視されています。
- 受容体チロシンキナーゼ様オーファン受容体1(ROR1)は、肺癌に特異的に発現し、腫瘍の増殖、転移、薬剤耐性に重要な役割を果たすことが報告されています。ROR1 は、CAR T細胞に基づく肺癌の治療標的として期待されています。
- 癌胎児性抗原(CEA)は、肺がん、大腸がん、胃がん、乳がん、膵臓がんの治療標的として注目されています。
- 研究者たちによって、その他にも、悪性胸膜中皮腫の治療薬である線維芽細胞活性化タンパク質(FAP)、前立腺がんの治療薬である前立腺特異的膜抗原(PSMA)など、固形腫瘍を標的とした抗原がいくつか発見されています。
CAR T療法を固形腫瘍の治療に応用するための課題
1. 腫瘍特異的な抗原の欠落
CAR T細胞の腫瘍細胞に対する殺傷活性は、主に腫瘍関連抗原(TAA)の認識に依存します。TAAは腫瘍細胞の表面に高度に発現していることが多いですが、他の正常組織細胞にもある程度は発現しています。そのため、CAR T細胞は腫瘍細胞を除去する一方で、正常な組織細胞も誤って攻撃してしまう可能性があります。このようなオフターゲット効果は、非腫瘍細胞を殺すことによる重大な副作用をもたらし、非特異的CAR T療法が所望の治療効果を得ることができなくなる可能性があります。
2. CAR T細胞のホーミングと浸潤
血液悪性腫瘍と比較して、CAR T細胞が血液系を介して固形腫瘍組織に侵入することは難しいとされています。一方、固形腫瘍はT細胞の輸送を妨害することで免疫回避を行うことが可能です。他方、ケモカイン-ケモカイン受容体のミスマッチ、接着分子のダウンレギュレーション、腫瘍新生血管の異常により、CAR T細胞が腫瘍に正確にナビゲートすることができなくなる恐れがあります。さらに、固形腫瘍のもう一つの特徴として、間質細胞に腫瘍関連線維芽細胞が大量に存在することが挙げられます。これらの細胞はコラーゲンを分泌することにより、高密度の線維性マトリックスを形成し、CAR T細胞の浸潤を捕捉・阻止し、その殺傷活性を減弱させる物理的バリアとして機能します。
3. 免疫抑制的な腫瘍微小環境
腫瘍微小環境(TME)は、がん細胞がその増殖を促進するために再設計された微小環境で、低酸素、低栄養、低pH、高浸透性という特徴を有しています。この環境は、腫瘍の増殖を促進することは可能ですが、CAR T細胞の生存には非常に不利な環境となっています。さらに、TMEには、腫瘍関連マクロファージ(TAM)、制御性T細胞(Treg)、骨髄由来抑制細胞(MDSC)など、さまざまな免疫抑制細胞も存在し、これらの免疫抑制細胞は複数の経路でCAR T細胞を阻害し、その殺傷効果を著しく低下させます。
CAR T細胞療法の最適化戦略
これらの課題に対処するため、研究者たちはすでに相当量の準備と前向きな研究を行ってきました。これまでに提案された主な対処法は以下の通りです。
1. CARの構造変更
CAR T細胞が、腫瘍の微小環境の特徴を変化させる炎症性サイトカインを同時に発現させ、体内でこれらの因子が継続的に発現して毒性を発揮しないようにするために、一部の研究では、標的発現に結合した後にサイトカイン産生を駆動するようにCAR T細胞を設計し、サイトカインの作用を腫瘍近傍に限定しています。その他、抑制性CAR分子の発現、デュアルターゲットによるCAR分子の活性化、scFvの親和性を高めてCAR T細胞の特異性を変えるなどの戦略により、抗腫瘍活性と安全性を最適化することが可能です。
2. CRISPRを介した遺伝子ノックアウト技術の利用
CRISPRを介した遺伝子ノックアウト技術を用いることで、腫瘍微小環境に対するCAR T細胞の感受性を低下させることができます。例えば、Tmunity Therapeutics社は、遺伝子編集技術を用いて、T細胞の内在性T細胞受容体(TCR)およびPD-1受容体の発現をノックアウトし、ニューヨーク食道扁平上皮がん1(NY-ESO-1)抗原を標的とするTCRを発現させることにより、CAR T細胞がより効率的に固形腫瘍部位に到達し、CAR T細胞が腫瘍微小環境で殺腫瘍作用を高めることを可能にします。
3. 併用療法
BioNTech社では、CLDN6 mRNAをコード化したワクチンをリポソームで送達しています。体内に注入された後、脾臓やリンパ節などにある抗原提示細胞(APC)は、CLDN6抗原を表面に提示することができます。これらのAPCによって、CLDN6 CAR T細胞の増殖が促進されます。また、CAR T療法と免疫チェックポイント阻害剤PD-1との併用により、固形腫瘍に対するCAR T療法の治療効果も向上しています。
固形腫瘍の治療における新規CAR T療法の臨床研究
CAR Tの生みの親であるCarl June(カール・ジューン)の研究チームによる最新の研究成果が、医学界のトップジャーナル「Nature Medicine」に掲載され、新しいCAR T療法が提案され、固形腫瘍治療への応用に新たな期待が寄せられています。固形腫瘍である転移性去勢抵抗性前立腺がん(mCRPC)の微小環境では、トランスフォーミング増殖因子-β(TGF-β)などの様々な阻害因子が存在し、CAR T細胞の効果を著しく低下させる可能性があります。研究チームは、遺伝子編集によりPSMAを標的としてCAR T細胞の関連受容体を不活性化することで、TGF-βのシグナル伝達を遮断してTGF-βの阻害作用に抵抗し、CAR T細胞の抗腫瘍能を増強することに成功しました。
これまでの動物実験で得られた良好な治癒効果をもとに、本療法は第I相臨床試験を実施しました。その結果、治療を受けた13名のmCRPC患者において、CAR T細胞が生体内で拡大・持続し、腫瘍組織で有意に濃縮されることが確認されました。有効性評価では、13人中4人の患者で前立腺特異抗原(PSA)が30%以上減少しました(図1-a)。また、CT評価では、3ヶ月後の放射線検査で5人(38.5%)が病勢安定を維持し、細胞治療後の1人の患者で腫瘍退縮が認められました(細胞注入後PSAが36%低下)(図1-b)。
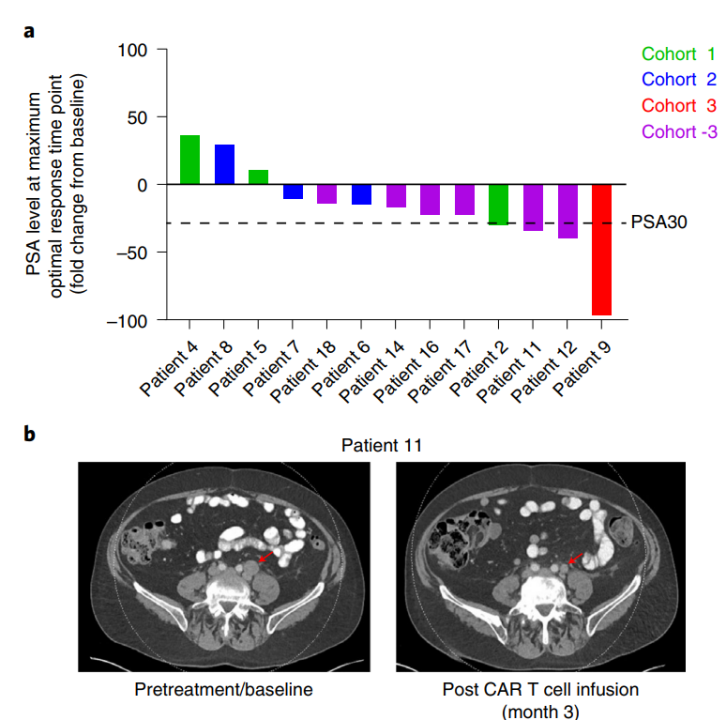
図1. CART-PSMA-TGFβRDN細胞療法後の病理学的および放射線学的評価[1]
研究は、固形腫瘍の治療におけるCAR Tの初の臨床研究でもあり、PSMAを標的とした抗TGF-β CAR T細胞療法がmCRPCなどの固形腫瘍の治療において実現可能で安全であることが確認され、固形腫瘍に取り組むCAR T療法に大きな意欲と自信を与える結果となりました。
CAR T細胞療法研究の将来:結論
CAR T療法による固形腫瘍の効果的な治療には、まだ多くの困難が待ち受けていますが、科学者の努力と探求は決して止まることはありません。腫瘍の微小環境やCAR Tの抗腫瘍効果に影響を与える因子を回避することを目的とした研究が増えてきています。これらの戦略と併用療法アプローチの可能性を組み合わせることで、CAR T療法が固形腫瘍の臨床治療を攻略する日が必ずやってくると信じています。
なぜサイヤジェンを選びますか。
弊社は、腫瘍免疫分野における長年の研究経験に基づき、CAR-Tおよび他の細胞治療研究者のニーズに応じてCARウイルスによる調製、腫瘍免疫細胞と動物モデルの構築から、in vivo/in vitroの薬効評価まで、あらゆるサービスを提供し、CAR-Tや細胞治療の開発プロセスをより加速させることを目指しています。
1. In vivo/in vitroのワンストップサービス提供が可能です。
サイヤジェンは、長年遺伝子編集細胞と動物モデルの構築に取り組み、経験豊富な専門家チームと成熟して安定したテクノロジープラットフォームを持ち、世界中の数十の国と地域に顧客がいます。研究者に目標遺伝子の発現調節ための細胞モデルと動物モデル、および関連する表現型解析、機能検証、病理学的解析などを提供することができ、あらゆるサービスのプラットフォームになります。
2. 成熟したレンチウイルスパッケージングおよびCAR-T細胞構築プラットフォーム
成熟、安定したウイルスパッケージングプラットフォームにより、第3世代のレンチウイルスパッケージングシステムは、ウィルスの滴定濃度が高く、細胞毒性が低く、汚染が無く、お客様の論文を複数引用されました。CAR-Tおよび細胞治療研究者の個性的なニーズに応じ、さらに異なる標的のCAR分子設計サービスを提供することもできます。
3. 腫瘍免疫マウスモデルの豊富なライブラリー
専門的に完備された細胞培養と全面的で厳格な動物繁殖管理システムにおいては、数千の腫瘍免疫研究ための細胞とマウスモデルライブラリが既に確立されています。お客様のニーズに応じて、各種効果的なCDXモデル、免疫不全マウス、免疫系統のヒト化マウス、相同腫瘍マウスモデルなどの評価モデルを提供することができます。お客様の全面的なニーズを満すため、各種類の皮下、インサイチューまたは転移性腫瘍モデルを構築し、対応するモデルに高度にカスタマイズされたインビボ薬力学的サービスを提供することができます。
4. 標準化と個性化を兼ね備える薬力学的評価サービス
サイヤジェンは、従来のウイルスパッケージング、動物モデルのカスタマイズに加えて標準化と個性化の薬効評価サービスを提供することができ、細胞治療の分野における各種類の表現型分析サービスをカバーしています。CAR-Tおよび細胞治療研究者に、確実にワンストップの薬力学的評価サービスを提供します。
今すぐお見積もり!または、[email protected] まで、サービスに関するお問い合わせやプロジェクトに関する詳細見積り依頼について、お気軽にご連絡ください。
参考文献:
[1] Narayan V, Barber-Rotenberg JS, Jung IY, et al. PSMA-targeting TGFβ-insensitive armored CAR T cells in metastatic castration-resistant prostate cancer: a phase 1 trial [published online ahead of print, 2022 Mar 21]. Nat Med. 2022;10.1038/s41591-022-01726-1.
