-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
キメラ抗原受容体(CAR)T細胞は、特定の腫瘍マーカーを認識する受容体を発現する遺伝子改変T細胞で、血液がんの治療薬として期待されています。現在までに8種類のCAR T細胞療法がFDAにより承認され、世界中で販売されていますが、いずれも血液腫瘍を適応としています。また、ほかにもいくつかのCAR T細胞療法についての臨床試験が進行中です。
しかし、CAR T細胞療法には、サイトカイン放出症候群(CRS)、神経毒性、抗原逃避、治療効果の持続性など、依然として大きな制約があります。特に固形腫瘍の治療においては、微小環境などの要因の影響もあり、これまでのところ大きな臨床的ブレークスルーはありません。本稿では、固形腫瘍治療におけるCAR T細胞療法の課題とその進展について考察していきます。
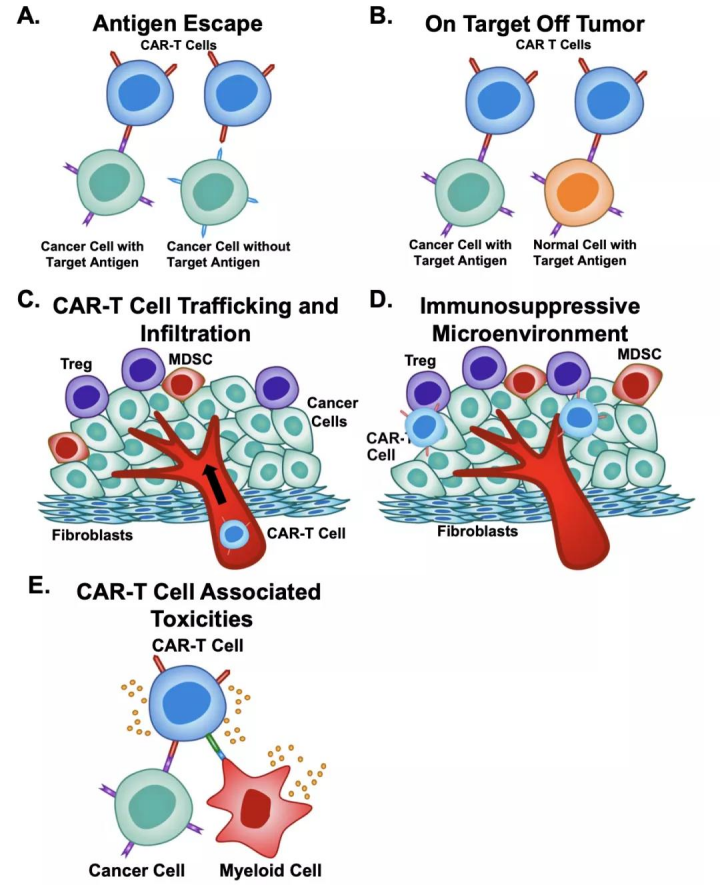
図1. CAR-T細胞療法における現在の課題[1](A)抗原逃避、(B)on-target off-tumor 反応、(C)腫瘍の移動と浸潤、(D)免疫抑制微小環境、(E)CAR-T細胞に関連する毒性
CARの分子構造
CAR T細胞が腫瘍細胞を殺傷する原理は、1.CAR分子の細胞外抗原結合ドメインが腫瘍抗原を特異的に認識し、2.認識シグナルがCAR分子の細胞内ドメインに伝わり、3.細胞内ドメインがT細胞を活性化して、細胞の増殖、パーフォリンやグランザイムなどの合成、サイトカインの放出、そして腫瘍細胞の殺傷を行います。これらの機能を最大限に発揮させるためには、CAR分子の構造設計が極めて重要です。
CARは、(1)細胞外標的抗原結合ドメイン、(2)ヒンジ領域、(3)膜貫通ドメイン、(4)1つ以上の細胞内シグナル伝達ドメインという4つの主要コンポーネントから構成されています。[1]
抗原結合ドメイン
抗原結合ドメインは、CARの中で標的抗原特異性を付与します。その原理は、モノクローナル抗体の可変重鎖(VH)と軽鎖(VL)を柔軟なリンカーで連結し、単鎖の可変フラグメント(scFv)を形成し、腫瘍表面抗原を特異的に認識することにあります。[1]
ヒンジ領域
ヒンジ領域は、膜貫通ドメインから結合ユニットを伸ばした細胞外構造領域と定義されます。立体障害を克服するための柔軟性を持ち、抗原結合ドメインが標的エピトープにアクセスするための長さに寄与しています。[1]
膜貫通ドメイン
膜貫通ドメインの主な機能は、CARをT細胞膜に固定することです[1]。膜貫通領域は、CARの発現量や安定性に影響を与え、シグナル伝達に関与している可能性があることが研究により示されています[2][3][4]。
細胞内シグナル伝達ドメイン
CAR工学では、CARの共刺激の効果が最も注目されています。1-3世代のCAR分子の主な違いは、細胞内共刺激ドメインにあります。最も一般的でFDAに承認されている2つの共刺激ドメイン、CD28と4-1BBは、どちらもT細胞の活性化に非常に有効で、T細胞が異なる機能を実行するように誘導することができます[5]。
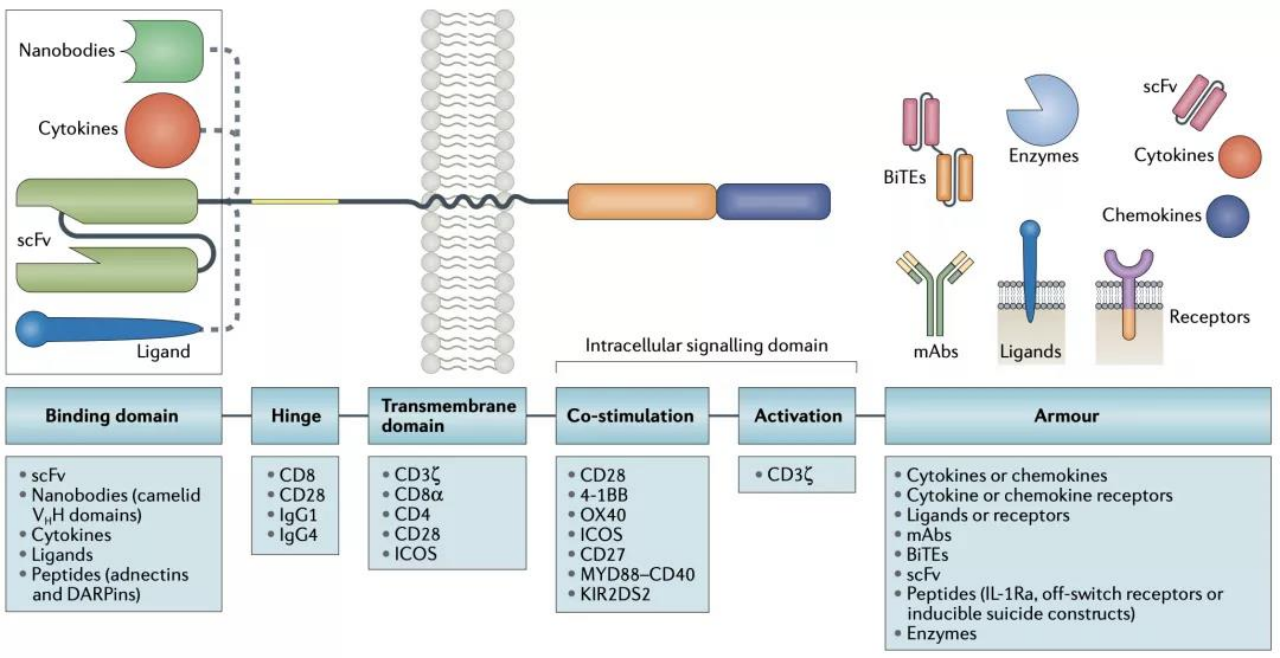
図2. CAR設計の青写真[20]
固形腫瘍におけるCAR T細胞療法の課題
腫瘍抗原の不均一性
腫瘍抗原の不均一性は、固形腫瘍に対するCAR T細胞療法の障壁の1つです。腫瘍抗原には、腫瘍関連抗原(TAAs)と腫瘍特異的抗原(TSAs)の2つのタイプがあります。TAAは腫瘍細胞で高発現し、正常組織細胞では低発現、TSAは腫瘍細胞でのみ発現し、正常組織細胞では発現しません。TSAの発見とスクリーニングは非常に困難であるため、CARの同定に最もよく用いられる標的はTAAです。腫瘍細胞の種類によってTAAの発現が異なるため、CAR T細胞によるがん細胞の認識に影響を与え、治療効果に影響を与える可能性があります。
CAR T細胞が複数の腫瘍関連抗原を識別するためには、1つのT細胞に複数のCARを共発現させる方法や、プログラム可能なCARの発現制御など、様々な方法があります。2つ以上の抗原認識ドメインを発現させることで、1つのCAR T細胞が腫瘍細胞に発現する複数の抗原を認識できるようになり、抗原の不均一性による弊害を排除することができます。
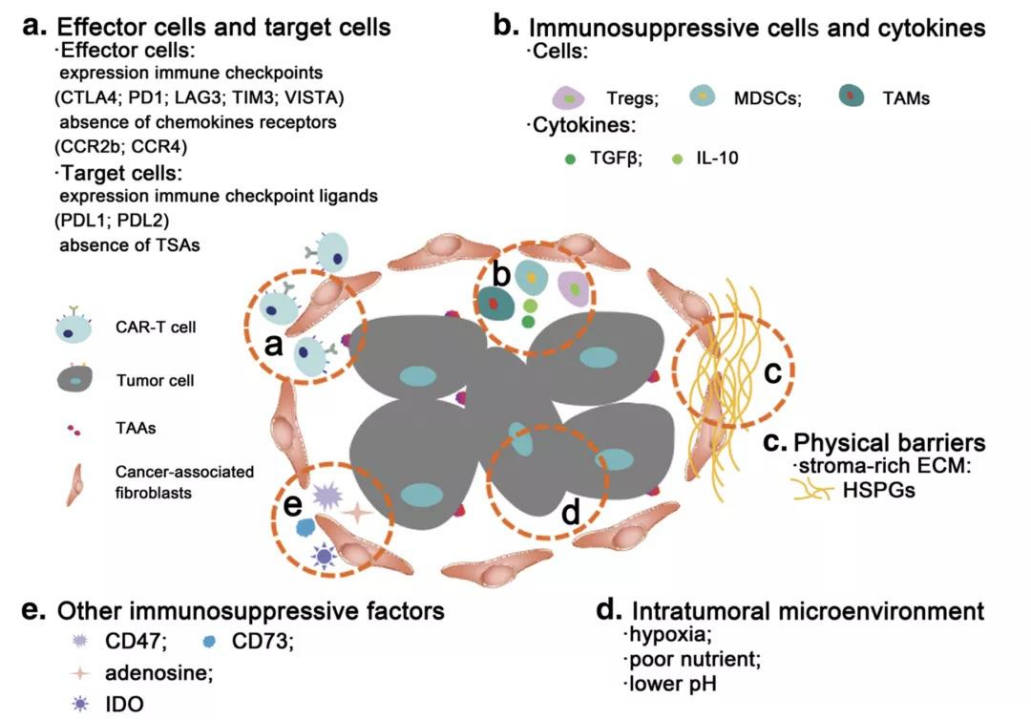
図3. 固形腫瘍における免疫抑制性微小環境[13]a エフェクター細胞と標的細胞、b 免疫抑制細胞とサイトカイン、c 物理的バリア、d 腫瘍内微小環境、e その他の免疫抑制因子
CAR T細胞の輸注と腫瘍組織への浸潤
CAR T細胞は、血液やリンパ系に存在することができます。そのため、血液腫瘍ではCAR T細胞は血液腫瘍細胞と接触する機会が多いのですが[1]、固形腫瘍では血液系を介した腫瘍組織への侵入が困難です[6]。さらに、固形腫瘍では、T細胞の腫瘍組織への侵入に関与するケモカインが発現していないこと、線維性間質が密に存在することから、CAR T細胞の腫瘍細胞への移動・侵入能力が低下する[7]とされています。
CAR T細胞を脳[8]、乳房[9]、胸膜[10]、肝臓など[11]の腫瘍部位に直接局所注入する方法が多く報告されています。CAR T細胞の局所注入により、オフターゲット効果のリスクを低減できると考えられています。しかし、多くの固形腫瘍は転移性であり、CAR T細胞の局所注入の大きな難点となっています。一方、ケモカインは、CAR T細胞の送達を媒介し、腫瘍のより正確な局在診断を可能にするためにいくつかの臨床研究で使用されています。例えば、マクロファージコロニー刺激因子1受容体(CSF-1R)をCAR T細胞に発現させると、多くの固形腫瘍に濃縮されている単球ケモカインのCSF-1に反応し、細胞の致死性と毒性を損なわずに、CAR T細胞増殖のシグナル伝達を強化することができます[12]。
固形腫瘍の腫瘍微小環境は、腫瘍の成長・増殖を促進する一方で、以下のようなCAR T細胞に対する免疫抑制を引き起こします。
- T制御細胞(Treg)、骨髄由来抑制細胞(MDSC)、腫瘍関連マクロファージ(TAM)などの免疫抑制細胞[13]、
- 成長因子、局所サイトカイン、固形腫瘍で産生されるCTLA-4やPD-1などの免疫チェックポイント分子。
Burgaら[14]は、マウスモデルでCAR Tの殺腫瘍効果を高めるために、遺伝子操作したGr-1抗体を使って骨髄由来抑制細胞(MDSC)を枯渇させました。また、細胞外マトリックス(ECM)を分解する酵素を分泌するCAR-T細胞を構築し、固形腫瘍の物理的バリアを破壊する報告もあります[15]。
固形腫瘍におけるCAR T細胞療法の進歩
近年、固形腫瘍の標的に関する研究が増え始め、かなりの数が臨床第II相に移行しています。固形腫瘍の一般的な標的と適応症を表1に示します。
|
標的 |
がん/腫瘍 |
臨床フェーズ |
|
メソセリン |
卵巣がん、子宮頸がん、膵臓がん、肺がん |
臨床第I/II相 |
|
MUC1 |
進行性固形腫瘍、肺がん |
臨床第Ⅰ/Ⅱ相 |
|
グリピカン-3 |
肝細胞がん |
臨床第Ⅰ相 |
|
GD2 |
脳腫瘍 |
臨床第I/II相 |
|
HER2 |
中枢神経系腫瘍、小児神経膠腫、乳がん |
臨床第I/II相 |
表1. 固形腫瘍の一般的な標的と適応症 (臨床データ出典:ClinicalTrials.org)
卵巣腫瘍の表面に高発現している腫瘍関連糖タンパク質72(TAG72)が、CAR T細胞療法の標的として用いられていることが報告されています[16]。本研究の著者らは、第二世代のTAG72-BBζ CARを構築し、TAG72-BBζ CAR T細胞の局所腹腔内投与により、マウスの腫瘍増殖が有意に減少し、全生存期間が延長することを示しました。また、MUC16やHER2を用いて構築したCAR分子は、腫瘍を標的とする性質を持ち、卵巣がん細胞の成長や増殖を抑制することが研究で明らかにされています。メソセリンは、細胞表面に存在する糖タンパク質で、様々ながん細胞で高発現していることが判明されています。
肝細胞がん治療において、CAR T細胞療法の研究は始まったばかりです。CAR T細胞を用いた癌胎児性抗原(CEA)、グリピカン-3、Mucin-1などの標的に対する研究は、肝細胞がんの治療において一定の成果を上げています。グリピカン(GPC3)抗体とCAR T細胞療法の組み合わせは、肝悪性腫瘍の有効な治療法となる可能性があります[21]。
肺がんの研究では、肺がんのA549細胞株を受容体チロシンキナーゼ様オーファン受容体1(ROR1)に特異的なCAR T細胞で処理したところ、強い抗腫瘍活性が示されました[18]。Srivastavaらは、ROR1 CAR T細胞の浸潤が悪く、機能不全であることを発見した後、オキサリプラチン/シクロホスファミド(Ox/Cy)化学療法で前処置を行いました。このレジメンは、腫瘍へのCAR T細胞の移動を改善し、抗PD-L1チェックポイント阻害剤と組み合わせることで生存率を向上させることができます[19]。さらに、CAR T細胞を用いたメソセリン、エリスロポエチン産生肝細胞受容体A2(EphA2)、およびPSCAとムチン1も肺がんの理想的な治療標的であることが他の研究で確認されています。
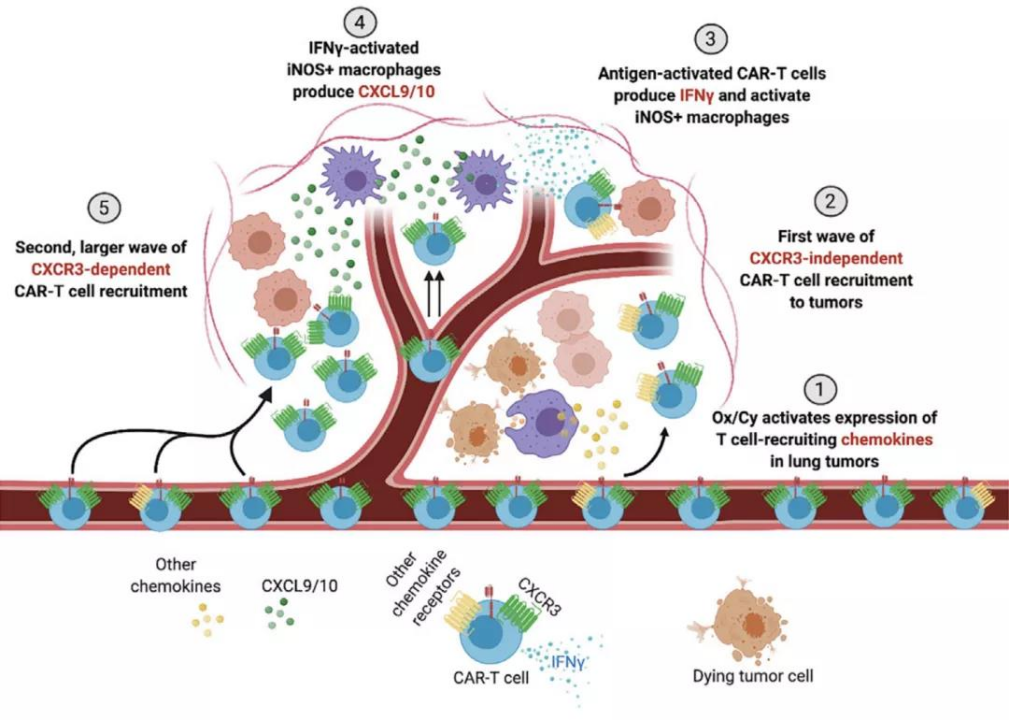
図5. Ox/Cy化学療法の前処置を併用したCAR T細胞療法[19]
CAR T細胞療法は、血液腫瘍の患者に希望を与え、進行性悪性腫瘍の治療にも期待されています。しかし、腫瘍の微小環境による免疫抑制、物理的バリア、抗原不均一性などの要因が、固形腫瘍におけるCAR T細胞の有効性を妨げています。研究者たちは、これらの課題を解決するために、多くの前向きな研究を行ってきました。斬新なアイデアと独創的なCAR工学設計は、常に繰り返され、更新され続けており、固形腫瘍のCAR T細胞療法に最適なソリューションの出現が待ち望まれています。
細胞療法研究におけるサイヤジェン・ワンストップソリューション
CAR-T治療原理の特殊性のため、CAR-T開発過程では治療標的の選択、CAR-T細胞の体内分布、および細胞毒性など多くの課題に適するものを検討する必要があります。弊社は、腫瘍免疫分野における長年の研究経験に基づき、CAR-Tおよび他の細胞治療研究者のニーズに応じてCARウイルスによる調製、腫瘍免疫細胞と動物モデルの構築から、in vivo/in vitroの薬効評価まで、あらゆるサービスを提供し、CAR-Tや細胞治療の開発プロセスをより加速させることを目指しています。
|
ウイルスベクター調製 |
腫瘍免疫モデル構築 |
In vitro薬力学的評価 |
In vivo薬力学的評価 |
|
|
|
|
今すぐお見積もり!または、[email protected] まで、サービスに関するお問い合わせやプロジェクトに関する詳細見積り依頼について、お気軽にご連絡ください。
参考文献:
[1] Sterner, R. C., & Sterner, R. M. (2021). CAR T cell therapy: current limitations and potential strategies. Blood Cancer Journal, 11(4), 1-11.
[2] Bridgeman, J. S., Hawkins, R. E., Bagley, S., Blaylock, M., Holland, M., & Gilham, D. E. (2010). The optimal antigen response of chimeric antigen receptors harboring the CD3ζ transmembrane domain is dependent upon incorporation of the receptor into the endogenous TCR/CD3 complex. The Journal of Immunology, 184(12), 6938-6949.
[3] Guedan, S., Posey Jr, A. D., Shaw, C., Wing, A., Da, T., Patel, P. R., ... & June, C. H. (2018). Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI insight, 3(1).
[4] Zhang, T., Wu, M. R., & Sentman, C. L. (2012). An NKp30-based chimeric antigen receptor promotes T cell effector functions and antitumor efficacy in vivo. The Journal of Immunology, 189(5), 2290-2299.
[5] Kawalekar, O. U., O’Connor, R. S., Fraietta, J. A., Guo, L., McGettigan, S. E., Posey Jr, A. D., ... & June, C. H. (2016). Distinct signaling of coreceptors regulates specific metabolism pathways and impacts memory development in CAR T cells. Immunity, 44(2), 380-390.
[6] Salmon, H., Franciszkiewicz, K., Damotte, D., Dieu-Nosjean, M. C., Validire, P., Trautmann, A., ... & Donnadieu, E. (2012). Matrix architecture defines the preferential localization and migration of T cells into the stroma of human lung tumors. The Journal of clinical investigation, 122(3), 899-910.
[7] Li, J., Li, W., Huang, K., Zhang, Y., Kupfer, G., & Zhao, Q. (2018). Chimeric antigen receptor T cell (CAR T) immunotherapy for solid tumors: lessons learned and strategies for moving forward. Journal of hematology & oncology, 11(1), 1-18.
[8] Brown, C. E., Alizadeh, D., Starr, R., Weng, L., Wagner, J. R., Naranjo, A., ... & Badie, B. (2016). Regression of glioblastoma after chimeric antigen receptor T-cell therapy. New England Journal of Medicine, 375(26), 2561-2569.
[9] Tchou, J., Zhao, Y., Levine, B. L., Zhang, P. J., Davis, M. M., Melenhorst, J. J., ... & June, C. H. (2017). Safety and efficacy of intratumoral injections of chimeric antigen receptor (CAR) T cells in metastatic breast cancer. Cancer immunology research, 5(12), 1152-1161.
[10] G. L., Haas, A. R., Maus, M. V., Torigian, D. A., Soulen, M. C., Plesa, G., ... & June, C. H. (2014). Mesothelin-specific chimeric antigen receptor mRNA-engineered T cells induce antitumor activity in solid malignancies. Cancer immunology research, 2(2), 112-120.
[11] Hardaway, J. C., Prince, E., Arepally, A., & Katz, S. C. (2018). Regional infusion of chimeric antigen receptor T cells to overcome barriers for solid tumor immunotherapy. Journal of vascular and interventional radiology: JVIR, 29(7), 1017-1021.
[12] Lo, A. S. Y., Taylor, J. R., Farzaneh, F., Kemeny, D. M., Dibb, N. J., & Maher, J. (2008). Harnessing the tumour-derived cytokine, CSF-1, to co-stimulate T-cell growth and activation. Molecular immunology, 45(5), 1276-1287.
[13] Zhang, E., Gu, J., & Xu, H. (2018). Prospects for chimeric antigen receptor-modified T cell therapy for solid tumors. Molecular cancer, 17(1), 1-12.
[14] Burga, R. A., Thorn, M., Point, G. R., Guha, P., Nguyen, C. T., Licata, L. A., ... & Katz, S. C. (2015). Liver myeloid-derived suppressor cells expand in response to liver metastases in mice and inhibit the anti-tumor efficacy of anti-CEA CAR T. Cancer Immunology, Immunotherapy, 64(7), 817-829.
[15] Caruana, I., Savoldo, B., Hoyos, V., Weber, G., Liu, H., Kim, E. S., ... & Dotti, G. (2015). Heparanase promotes tumor infiltration and antitumor activity of CAR-redirected T lymphocytes. Nature medicine, 21(5), 524-529.
[16] Murad, J. P., Kozlowska, A. K., Lee, H. J., Ramamurthy, M., Chang, W. C., Yazaki, P., ... & Priceman, S. J. (2018). Effective targeting of TAG72+ peritoneal ovarian tumors via regional delivery of CAR-engineered T cells. Frontiers in immunology, 9, 2268.
[17] Cao, B., Liu, M., Wang, L., Liang, B., Feng, Y., Chen, X., ... & Zhang, Z. (2020). Use of chimeric antigen receptor NK-92 cells to target mesothelin in ovarian cancer. Biochemical and biophysical research communications, 524(1), 96-102.
[18] Wallstabe, L., Göttlich, C., Nelke, L. C., Kühnemundt, J., Schwarz, T., Nerreter, T., ... & Hudecek, M. (2019). ROR1-CAR T cells are effective against lung and breast cancer in advanced microphysiologic 3D tumor models. JCI insight, 4(18).
[19] Srivastava, S., Furlan, S. N., Jaeger-Ruckstuhl, C. A., Sarvothama, M., Berger, C., Smythe, K. S., ... & Riddell, S. R. (2021). Immunogenic chemotherapy enhances recruitment of CAR T cells to lung tumors and improves antitumor efficacy when combined with checkpoint blockade. Cancer Cell, 39(2), 193-208.
[20] Rafiq, S., Hackett, C. S., & Brentjens, R. J. (2020). Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nature reviews Clinical oncology, 17(3), 147-167.
[21] Marofi, F., Motavalli, R., Safonov, V. A., Thangavelu, L., Yumashev, A. V., Alexander, M., ... & Khiavi, F. M. (2021). CAR T cells in solid tumors: challenges and opportunities. Stem cell research & therapy, 12(1), 1-16.
