-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
前回は、糖尿病網膜症(DR)の前臨床研究について説明し、一般的なDRの動物モデルについて紹介しました。DRでは、異常な血管が網膜を引っ張るため、時間の経過とともに視力が徐々に低下していきます。また、網膜剥離の症状としては、飛蚊症(黒い点)が現れたり、目の前の世界が霧に覆われたように遠くのものが見えにくくなったりすることもあります。
糖尿病網膜症(DR)は、通常、患者の障害が進行するため、進行度に応じた適切な治療法が特に重要です。本日は、DRの重要な治療法として、手術治療と遺伝子治療の2つをご紹介します。
糖尿病網膜症(DR)に対する手術治療
現在、糖尿病網膜症の治療は、主に外科手術に頼っています。近年、医療技術の急速な発展により、レーザー光凝固術の治療効果も絶えず向上しています。
汎網膜光凝固術(PRP)
汎網膜光凝固術(PRP)は1960年代に提唱された治療法で、増殖DR患者の視力低下を防ぐことができます。PRPの主な作用機序は、光凝固による傷跡が網膜微小循環の血行動態を緩和し、網膜の酸素化を改善することで、血管内皮増殖因子などの産生を抑制して治療目的を達成することにあります。しかし、PRPはレーザーの破壊力により、視野暗点を誘発するなどの一定の副作用があり、硝子体出血や二次性新生血管形成などの合併症を起こす可能性があります。
硝子体手術(PPV)
増殖DRの患者が硝子体出血や牽引性網膜剥離などの視力を脅かす合併症を発症した場合、主な治療法は硝子体手術(PPV)と、PRPとなります。
硝子体を切除すると、眼球内の出血が取り除かれ、眼底の観察が可能になります。また、血管内皮増殖因子(VEGF)や炎症因子の濃度を低下させ、眼内微小環境をさらに改善することができます。術中に線維血管膜(FVM)を剥離することで、牽引効果を緩和し、網膜の解剖学的構造を回復させることができます。したがって、PPV治療は、臨床的な増殖DR患者にとって、大きな意義を持っています。
しかし、新生血管は脆弱であるため、眼内出血はしばしば避けられず(特にFVMを除去する場合)、PPV手術の難易度を大きく高めています。これまでの眼底疾患の臨床例では、医師は主に眼圧上昇や電気凝固により、手術中の活動性出血を抑制していました。しかし、高眼圧が長く続くと角膜上皮の浮腫を引き起こし、術野の確保を難しくなります。そして、過度の凝固は網膜の壊死を招き、術後の炎症反応を悪化させる可能性があります。複数の網膜出血を取り除くため、あるいはFVMを分離するために硝子体カッターを使用すると、新たな網膜裂孔を引き起こす可能性があります。したがって、増殖DR患者に対するPPV治療は、その手術の難しさから一定の失敗率があります。
DRに対する遺伝子治療
遺伝子治療は、従来の医学的アプローチと比較して、世界中で本格的に発展している革新的な研究分野です。同様に、遺伝子治療は、DRなどの眼底疾患の診断や治療にも新たな可能性をもたらしています。ここでは、網膜疾患をターゲットとした遺伝子治療の事例を紹介します。
Colellaら[1]は、VEGFトランスジェニックマウスモデルを構築し、AAVベクターを用いて可溶性受容体sFlt-1の遺伝子導入を行いました。このベクターを網膜下に注射することで、治療用遺伝子を眼球内で発現させ、網膜の微小血管異常の発生を効果的に抑制することができます。
VEGFの発現量の増加は、眼球の新生血管形成と関連しています。Ambatiら[2]は、未熟児網膜症(ROP)モデルマウスを構築し、アデノウイルス(ADV)およびAAVベクターを用いてそれぞれsFlt-1遺伝子導入を行いました。その結果、正常なマウスの眼球はVEGFの発現が低く、sFlt-1の発現が高いことがわかり、sFlt-1はVEGFの発現を抑制して眼球を保護することが明らかになりました。しかし、ROPマウスの眼球では、VEGFの発現が有意に増加し、sFlt-1は抑制されました。この実験では、ウイルスを介した細胞でのsFlt-1遺伝子の高発現が、ROPマウスの治療効果を発揮していることが確認されました。
Díaz-Lezamaら[3]は、AAVベクターを介した血液網膜関門(BRB)損傷抑制剤を用いて、糖尿病黄斑浮腫(DME)に対する有効性を検討しました。まず、ストレプトゾトシン(STZ)を用いてラットに糖尿病を誘発しました。2週間後、硝子体中のアルブミン含有量を検出すると、血液網膜関門(BRB)が損傷し、アルブミン含有量が有意に増加しました。しかし、VEGF抗体を過剰発現させたAAVを注射したラットの眼球のアルブミン含量は糖尿病誘発2週間後も正常であり、この遺伝子治療が血液網膜関門を保護することが証明されました。
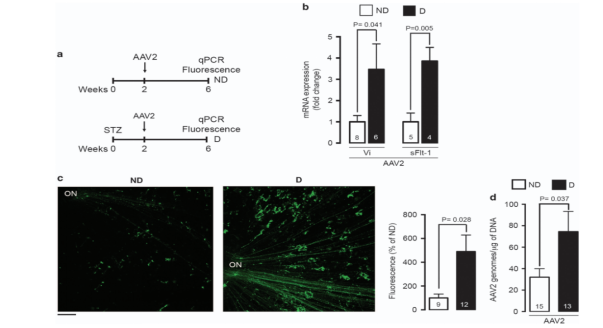
図1. 網膜の伸展調製とqPCRにより、AAV2が標的遺伝子を正常に導入できることが証明された[3]
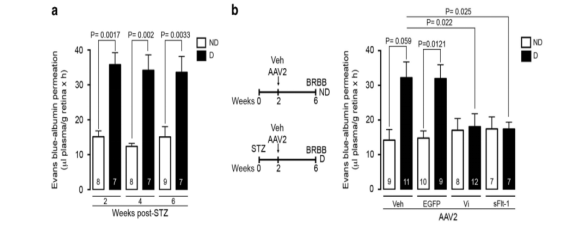
図2. VEGF抗体を過剰発現するAAVを注射した糖尿病ラットの注射前後のアルブミン量[3]
眼科研究を加速させるげっ歯類モデル
サイヤジェンは、包括的な医薬品開発業務受託機関(CRO)ソリューションプロバイダーとして、眼科疾患を遺伝子治療の「ブレークスルー」として捉え、眼科遺伝子治療プラットフォームを確立しています。当社は、遺伝子改変動物モデル、完全ヒト化マウスモデル、手術モデル、および前臨床試験(薬効薬理試験)を通じて研究を加速させるダウンストリームサービスを提供することができます。眼科領域での医薬品開発プロジェクトに関するご質問やご相談は、ぜひ当社の専門家にお問い合わせください。無料にて承っております。
|
疾患 |
遺伝子 |
適用技術 |
|
レーバー先天性黒内障2型(LCA2) |
RPE65 |
KO, MU (p.R44*) |
|
レーバー先天性黒内障10型(LCA10) |
CEP290 |
Humanization |
|
レーバー先天性黒内障(LCA) |
RDH12 |
KO |
|
網膜色素変性症 (RP) |
MERTK |
KO+CKO |
|
PDE6B |
KO |
|
|
RHO |
KO+CKO, humanization, humanization (MU: P23H) |
|
|
RPGR |
KO |
|
|
CRB1 |
KO |
|
|
RD1 |
Mut |
|
|
RD10 |
Mut |
|
|
加齢黄斑変性(AMD) |
hVEGF |
KI, TG |
|
スターガルト症 |
ABCR/ABCA4 |
KO, humanization |
|
先天性脈絡膜欠如 |
CHM |
CKO |
|
アッシャー症候群2型 |
USH2A |
Humanization |
|
角膜内皮ジストロフィー |
TCF4 |
KO+CKO |
|
常染色体劣性遺伝性ベストロフィノパシー |
BEST1 |
KO |
|
網膜変性
|
Prph2/Rds |
KO |
|
Tub |
KO |
|
|
色覚異常 |
CNGA3 |
KO+CKO |
表1. サイヤジェンが開発した遺伝子治療研究用の眼科疾患マウスモデル
参考文献:
[1] Colella, P., & Auricchio, A. (2010). AAV-mediated gene supply for treatment of degenerative and neovascular retinal diseases. Current gene therapy, 10(5), 371–380.
[2] Ambati, B. K., Patterson, E., Jani, P., Jenkins, C., Higgins, E., Singh, N., Suthar, T., Vira, N., Smith, K., & Caldwell, R. (2007). Soluble vascular endothelial growth factor receptor-1 contributes to the corneal antiangiogenic barrier. The British journal of ophthalmology, 91(4), 505–508.
[3] Díaz-Lezama, N., Wu, Z., Adán-Castro, E., Arnold, E., Vázquez-Membrillo, M., Arredondo-Zamarripa, D., Ledesma-Colunga, M. G., Moreno-Carranza, B., Martinez de la Escalera, G., Colosi, P., & Clapp, C. (2016). Diabetes enhances the efficacy of AAV2 vectors in the retina: therapeutic effect of AAV2 encoding vasoinhibin and soluble VEGF receptor 1. Laboratory investigation; a journal of technical methods and pathology, 96(3), 283–295.
[4] Methods & Clinical Development, 24, 210-221.
[5] Buck, T. M., & Wijnholds, J. (2020). Recombinant adeno-associated viral vectors (rAAV)-vector elements in ocular gene therapy clinical trials and transgene expression and bioactivity assays. International journal of molecular sciences, 21(12), 4197.
[6] Telias, M., Denlinger, B., Helft, Z., Thornton, C., Beckwith-Cohen, B., & Kramer, R. H. (2019). Retinoic acid induces hyperactivity, and blocking its receptor unmasks light responses and augments vision in retinal degeneration. Neuron, 102(3), 574-586.
[7] Lee, S. H., Kim, Y. S., Nah, S. K., Kim, H. J., Park, H. Y., Yang, J. Y., ... & Park, T. K. (2018). Transduction patterns of adeno-associated viral vectors in a laser-induced choroidal neovascularization mouse model. Molecular Therapy-Methods & Clinical Development, 9, 90-98.
