-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
RIPK1(受容体相互作用プロテインキナーゼ )は、死亡信号をコントロールするキーファクタとして、最近の研究の人気な話題となっている。面白いことに「二つの顔」のようなものです。一方、ripk1ステントmapk促進とNF-κB通路としての活性化、アポトーシスと壊死性在性壊死を抑制した。一方、キナーゼとしては、細胞の枯れと壊死を誘導する。RIPK1がどのようにダブル役割を自由に切り替えられるかは、まだはっきりしていない。
ベルギーのVIB炎症研究センターの率いる研究チームはこのほど、IKKα/βは、RIPK1第25位セニンのリン酸化を検出した。「分子ブレーキ」として、直接RIPK1のキナーゼ活性を抑制し、TNF介導のRIPK1キナーゼ依存性細胞の死を防ぐ。
4月号の「ネイチャーコミュニケーションズ」では、生きていることと死を促すことでRIPK1が自由に変换できるように巧妙な分子構造を報道され。モデルマウスの感染と炎症における生理的相関性を証明した。
RIPK1のSer25順位は燐酸化した
以前の研究によると、RIPK1は、IKKαとIKKβの直接底物である。そこで、研究者は、RIPK1にあるリン酸化残基を、野生型とIkk−β−β−−マウスの胚から繊維細胞に分離し、LC-MS/MSの質量分析を行った。彼らは、IKKα/βが不足する場合、RIPK1にはSer6、Ser25のリン酸化が大幅に低くなることを発見した。これまでの研究結果を踏まえ,RIPK1のSer25順位は,直接リン酸化したことが確認された。
アナログSer25リン酸化化、TNF誘導の細胞死を回避
IKKα/β介導のpS25 RIPK1における生理的相関性を確認するため、研究者はサイヤジェン株式会社のCRISPR/Cas9技術によりシミュレーションリン酸化をしたS25D RIPK1をノックインマウス。Ripk1S25D/S25Dマウスは健康的で、かつRIPK1表現のレベルがripk +/+マウスとは違いがないということは、S25Dの突然変異がripk 1の安定性に影響を与えないことを示している。
彼らはこれらのマウスから骨髄の源となっていた大食細胞(BMDM)とマウスが繊維細胞(MEF)として分離され、実験を行う。彼らは、caspase抑制剤(zVAD)が存在しない状態で、pS25 RIPK1はBMDMとMEFを、TNFから誘導されるRIPK1キナーゼ依存性細胞の消失と壊死性アポストレーションから非常に保護していることを、S25Dに突然変異して発見した(図1)。
研究者は、IKKiが亜致死量のTNFと一緒に薬を投与すると体温が低すぎると発見した。特に、Ripk1S25D/+とRipk1S25D/S25Dのマウスは、このような致命的な攻撃を避けることができる。IKKiではなく、致死量のTNFを投与すると、これらのマウスも保護されている。つまり、これらの结果は、IKKα/β介導のpS25 RIPK1が体外および体内で重要な保护作用を果たし、TNFによる细胞の死を避けることができることを强调している。
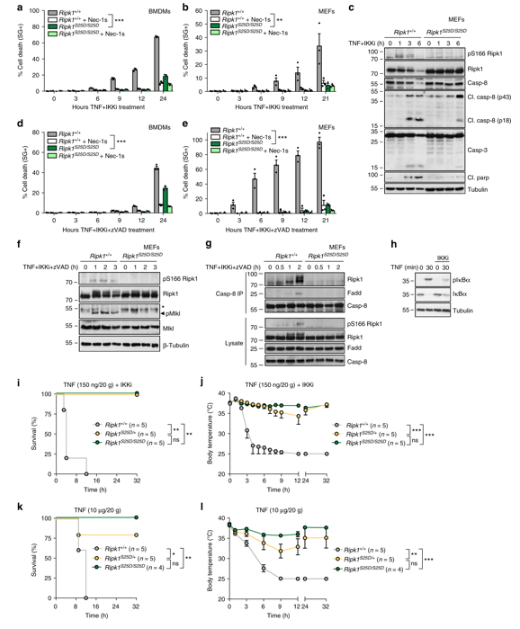
図1. アナログSer25リン酸化化、TNF誘導の細胞死を回避
Ser25リンはYersiniaの感染による免疫反応を酸化して調節する
Yersiniaのネズミ感染症は通常のモデルです。イェルセニア菌が細胞に感染すると、毒タンパク質YopJ/PはIKKとTAK1の触媒活性を抑え、炎症を促す環境の表現をブロックすることで宿主からの防御を逃そうとする。この乗っ取りに対応するため、RIPK1キナーゼ依存性細胞の消失は、宿主細胞の感染に対応するための予備機構となっている。
研究者の分析によると、Y. enterocolitica(表現YopP)とY. pseudotuberculosis(表現YopJ)が細胞に感染した後、シミュレーションpS25 RIPK1のBMDMは、YopJ/P依存性細胞から消滅しない。Ripk1S25D/S25D BMDMで観察される保護作用は、RIPK1キナーゼの活性を薬理的または遺伝的に抑制する効果に相当する。これらの結果から,YopP/Jは,RIPK1 Ser25リンの酸化を抑制することで,Yersiniaの感染に対応するバックアップメカニズム,つまりRIPK1キナーゼ細胞を活性化させたという。
Ser25リン酸化障害は多器官の炎症を起こす
もう1つのシャーpin欠陥型マウスのモデルでは、RIPK1キナーゼ依存性細胞の死が有害な役割を果たしている。マウスの慢性的な成長性皮炎(cpdm)は、pin表現の欠如による多臓器炎性疾患で、TNF/TNFR1の介導を誘導するRIPK1キナーゼ依存性細胞の衰退や壊死性の減少をもたらす。
SHARPINがIKKα/β活性化に機能していることを考慮し、研究者はSHARPIN欠陥型マウス(Shpncpdm / cpdm)から、マウスの皮膚から繊維細胞(MDF)に分離し、TNFが誘導するpS25 RIPK1に欠陥があることを発見した。その後、Ser25リン酸化をS25Dの突然変異によって回復させ、それがTNFの誘導細胞から細胞を滅亡から守ることができることを発見した。更に重要なことに、Ripk1S25D / S25DマウスとShpncpdm / cpdmマウスの交配は、後者の多臓器炎症の表現型(図2)を完全に救った。
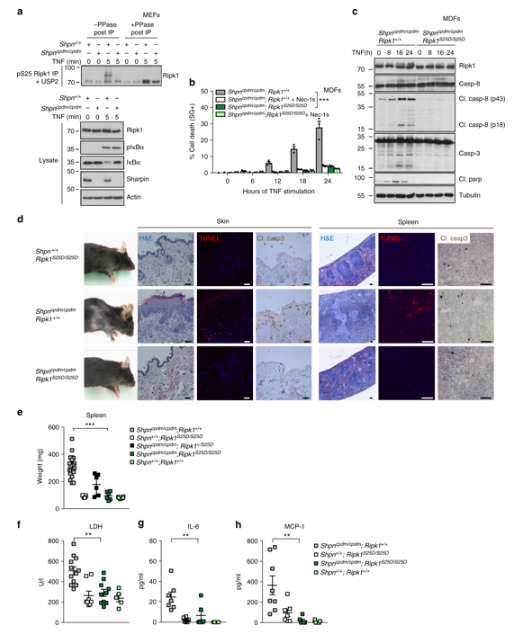
【図2】Ser25リン酸化欠陥が多臓器炎症を起こす
Ser25リンはRIPK1触媒の活性を直接抑えた
Ser25は、構造分析によると、RIPK1β1-β2のピン内にあるキナーゼ構造領域にあり、ATPとの位置に隣接するグリセリンリングを豊富に含む。これは、タキナーゼにおける最も保守的なmotifの一つである。彼らは、Ser25のリン酸化がヌクレオチドの結合に影響すると予想する。そして、RIPK1を再構成してキナーゼ分析を行ったところ、S25Dシミュレーションリン酸化突然変異がRIPK1のキナーゼ活性に大きく影響していることがわかった。このため、セル表面受容体が結合する間、Ser25のリン酸化は、RIPK1の活性化を直接抑えるように見える(図3)。
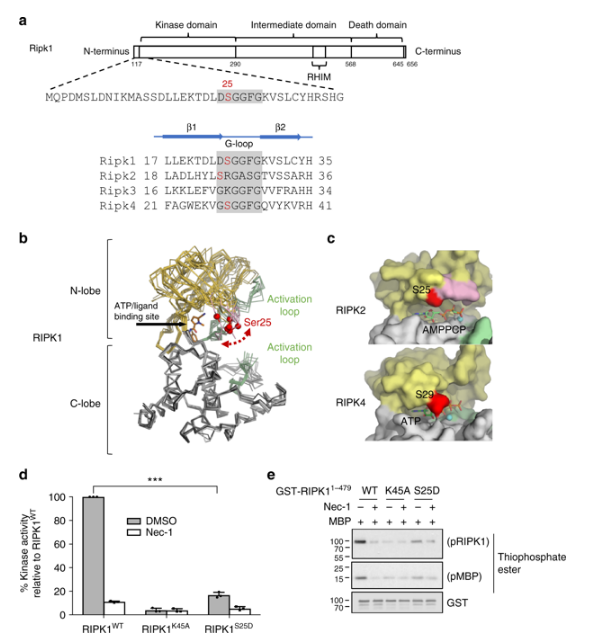
図3. Ser25リン酸化により、RIPK1触媒の活性が直接抑えられる
研究者は、「本研究では、IKKα/βが、RIPK1にSer25のリン酸化を分子としてブレーキをかけ、RIPK1のキナーゼ活性を直接抑制することを明らかにした。炎性細胞の死に対するコントロールを理解することに役立ち、薬理学的介入の的となることが期待される」とまとめた。
論文検索
Serine 25 phosphorylation inhibits RIPK1 kinase-dependent cell death in models of infection and inflammation
Nature Communications 10, Article number: 1729 (2019)
サイヤジェン株式会社について
サイヤジェン株式会社は15年間の発展を経て、全世界の数万人の科学研究者にサービスを提供しており、製品と技術は直接にCNS (Cell、Nature、Science)の定期刊を含む5,200余りの学術論文に応用されています。弊社の「ノックアウトマウスライブラリ」は低価格だけでなく、遺伝子名称を入力すれば、ワンクリックで注文まで操作できます。 ノックアウトマウス、ノックインマウス、コンディショナルノックアウトマウス、トランスジェニックマウス、GFPマウス、免疫不全マウス、無菌マウスなどのカスタマイズサービスを提供する以外、専門的な手術疾患モデルチームがあり、多種の複雑な小動物手術疾患モデルも提供できます。
最新のプロモーション:
