-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
Dr.Liu
新型コロナウイルスとの戦い、全世界の科学研究者と医療関係者を日々絶えず努力することが必要である。7月以来、科学者たちは自主的な研究開発と団体協力を通じ、中和抗体の開発及びワクチンII期の臨床実験を成功させ、さらに続き実験において人類とウイルスの戦いに良い結果が期待される。
ここで、中和抗体とワクチンに関する問題を紹介します。中和抗体を研究する意義とは?新型コロナワクチンの現在の成果は?私たちはどうやってモデル動物を使用し、ワクチンの安全性と有効性を検証するか?
1、中和抗体の研究とは
ウイルスが機体に侵入する時、体の中に相応の抗体を発生してウイルスを中和し、ウイルスの体に対する侵害を減少させ、病原微生物が標的細胞受容体を通し、細胞に侵入するのを阻止することが可能である。
一般的に、新型コロナなどの伝染病の研究はバイオセーフティーレベル3級以上の生物実験室で扱う必要である。しかし、ウイルス学の研究の過程で、偽型ウイルスの応用はウイルス中和抗体医薬及びワクチンの研究において大きな役割があると研究者たちが発見した。偽型ウイルスはほとんどウイルスディスプレイに使用されて、伝播力がないため、それに対応するウイルス研究の実験環境は特に厳しくなく、BSL生物安全2級以上で操作可能である。
コロナウイルスの偽型ウイルス中和抗体の研究について、SARSから話す必要です。2005年にSARSウイルスが爆発し、人々は対応が間に合わなかった。SARSウイルスが急速で進展し、多くの関連研究が行き詰まったが、その中で依然と実行されたプロジェクトが、今のSARS-CoV-2に対応することは参考になれる。まず、2005年にイギリスのロンドン大学Robin A.Weiss教授チームがEmerging infectious Diseaseで発表した文献Longitudinally Profiling Neutralizing Antibody Response to SARS Coronavirus with Pseudotypesを見よう。本文でSARS-CoVの棘突起タンパクSは中和抗体の主な標的であり、逆転写ウイルスSに関連する偽型ウイルスを構築することにより、SARS-CoVの中和抗体の調製に成功し、この抗体が患者のSARS-Sタンパク質に中和反応があると指摘している。この研究は自然感染過程における中和抗体の効果及びワクチンの臨床評価に重要な意義がある。一方、研究者はマウスやハムスターで行った前臨床研究で、中和抗体は明らかに生きるウイルスの攻撃を防ぐことができることを発見した。これらの研究結果は中和抗体薬物の研究はある程度にウイルスの侵入に抵抗できることを説明する。
2020年3月を戻し、中国の医科院病原微生物研究所はNature Communicationで研究論文を発表し、SARS-CoV-2-Sタンパク質のウイルスが細胞に侵入する時にどのような特徴を示すか偽型ウイルスを利用し証明し、SARS-CoVとの間で発生する免疫的交差反応について述べた。本研究はレンチウイルスSARS-CoV-2-S偽型ウイルスシステムを使って、Huh7、Vero81、LLCMK2、Calu3などの細胞がこのシステムに対する感受性を確認し、ウイルスが受容体ACE2と結合して細胞に入る経路も詳しく述べた。CoV Sタンパク質は典型的なI類ウイルス融合タンパクであり、Sタンパク質の融合ポテンシャルを活性化するのにプロテアーゼカットが必要である。ウイルスSタンパクのS1とS2の間で切断する。ウイルス株と細胞タイプによって、CoV Sタンパク質はフイルムプロテアーゼ、膵プロテアーゼ、組織プロテアーゼ、膜貫通アルギニンプロテアーゼ2(TMPRSS-2)、TMPRSS-4或いはヒト気道膵プロテアーゼ様プロテナーゼ(HAT)を含む1つまたは複数の宿主プロテアーゼによって切断されるかもしれない。これらのプロテアーゼの標的細胞の存在はコロナウイルスが細胞膜を通して細胞に入るか、エンドサイトシス作用を通して細胞に入るか大きく左右される。
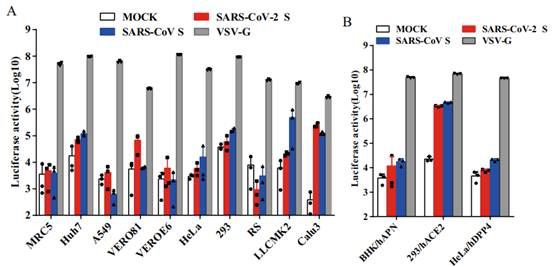
Fig1. SARS-CoV-2-S偽型ウイルスが細胞に侵入する
(Xiuyuan Ou et al. 2020)
研究はさらに可溶性hACE2のフローサイトメトリーと競合抑制実験分析により、SARS-CoV-2とSARS-CoVの両方のウイルスのSタンパク質がhACE2をウイルス結合の受容体とすることを実証した。
コロナウイルスSタンパク質はウイルスの毒力の重要な因子であり、ウイルスの毒力、組織の嗜好性と宿主範囲を決定する肝心な部分であり、中和抗体とワクチンの主な標的でもある。SARS-CoV-2-SとSARS-CoV-Sに対する免疫交差反応はどのように現れるか?
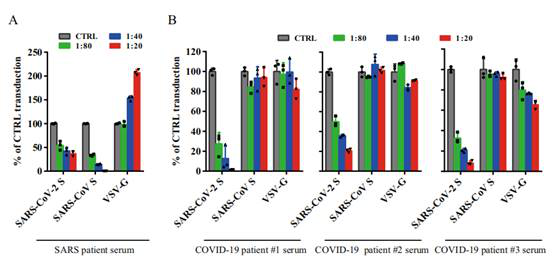
Fig2. SARSとCOVID-19患者の血清の交差中和反応
(Xiuyuan Ou et al. 2020)
回復したSARS患者の血清はSARS-CoV S偽型ウイルス粒子の侵入を強く抑制し、SARS-CoV-2 S偽型ウイルス粒子に適度な中和活性を持つことが研究でわかった。
時間が経つにつれて、7月に中和抗体の研究結果が次第に明らかになる。いろいろないい結果は我々が防疫の未来に自信を溢れさせている。7月9日、北京大学ゲノム学先進イノベーションセンター(ICG)と生物医学パイオニアイノベーションセンター(BIOPIC)などが共同文献Cellで発表し、新型コロナから回復した患者のB細胞に対して高スループット単細胞シークエンシングを行い、SARS-CoV-2に対する有効な中和抗体を鑑定した。
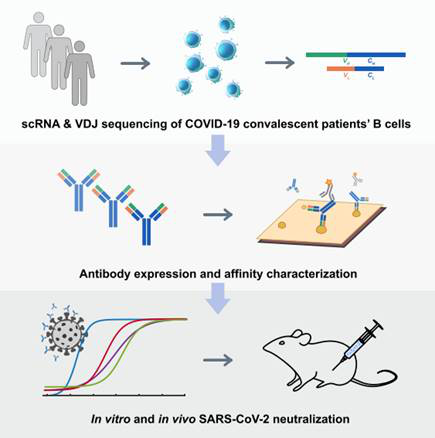
Fig3. SARS-CoV-2中和抗体の発生
(Yunlong Cao et al. 2020)
高スループットscRNA/VDJ-seqのシークエンシングによりIgG1+抗原結合クローン型を8558個同定し、60人の回復患者の中から14種類の有効なSARS-CoV-2中和抗体を発見した。SARS-CoV-2正常ウイルスとSARS-COV-2 VSV偽型ウイルスシステムを使って検証したところ、最も有効な中和抗体はBD-368-2であり、BD-368-2はSARS-COV-2に感染したhACE2トランスジェニックマウスに対して強力な治療と予防作用を示した。一方、バイオインフォマティクスの分析方法を利用して、モノクローナル抗体CDR3Hの構造を予測し、mAbでSARS-CoV中和抗体m396と非常に似たCDR3H構造がSARS-CoV-2に非常に高い中和効果を持つことが確認された。
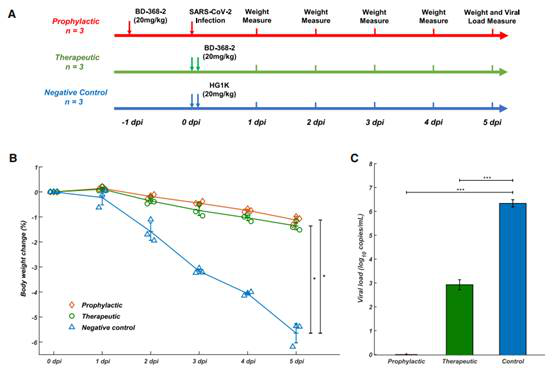
Fig4. BD-368-2はSARS-CoV-2に感染したhACE2トランスジェニックマウスに対して高い治療と予防作用がある
(Yunlong Cao et al. 2020)
7月23日、中国科学院生物物理学所の王氏研究員は複数のチームと共同協力し、ファージディスプレイ技術によりコロナウイルス抗体ライブラリを構築し、高スループットスクリーニングによりβコロナウイルスに対して広域スペクトル中和能力を持つ抗体H014を同定した。
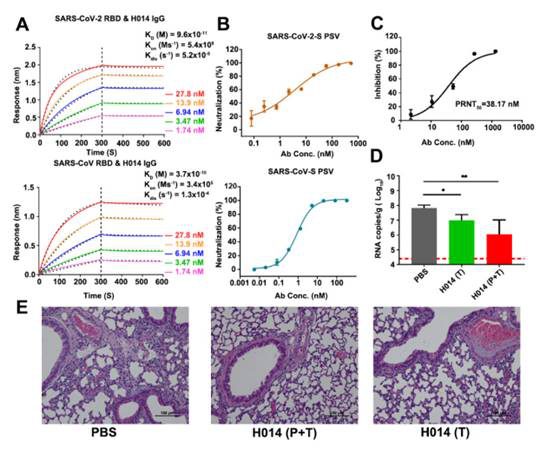
Fig5. クロス中和抗体H014の検証
(Zhe Lv et al. 2020)
ヒト化モノクローナル抗体H014はS受容体結合ドメイン(RBD)と結合することで、偽型ウイルスSARS-CoV-S PSVおよび正常ウイルスSARS-CoV-2を効果的に中和することができる。hACE2マウスモデルにおいて、H014の薬物投与は肺部に感染するSARS-CoV-2ウイルスの力価を低減でき、肺部の病理変化を軽減できる。
以上の研究は中和抗体スクリーニングの方法とその検証結果を提供し、抗ウイルス薬の開発に重要な指導意義を持っている。また、ワクチン標的の探索に方向を示した。
2、新型コロナワクチンの研究開発の進展
7月21日までに、世界で25種類の新型コロナ候補ワクチンが臨床試験段階に入った。そのうち、少なくとも4種類のワクチンがIII期の臨床試験に入った。
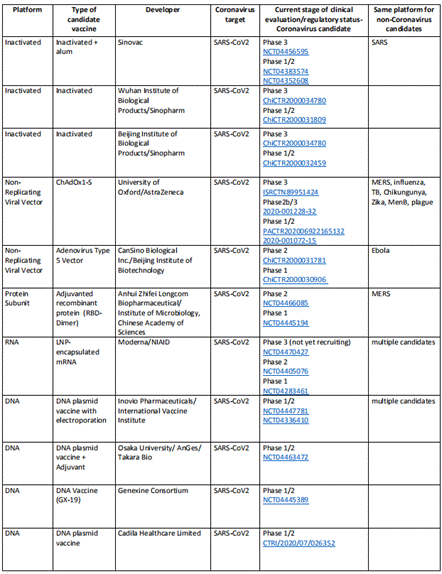
Table1:一部の研究しているワクチンの進展状況
(グラフ情報はウイルス学界の7月28日の文章『新型コロナワクチン研究開発が絶えず「突破」している』を参考する)
ワクチンは病原微生物を人工的に減毒したり、不活化したり、遺伝子工学などで調製した伝染病予防のための自動免疫剤である。伝統的なワクチンは人工能動免疫と受動免疫ワクチンに分けられている。人工能動免疫ワクチンは不活化ワクチン、減毒ワクチンとアナトキシンワクチンの3種類に分けられている。人工受動免疫の方式は抗毒、ヒト免疫グロブリン製剤、サイトカイン製剤とモノクローナル抗体製剤がある。両方式の免疫はいずれも機体の抗病能力を増強させ、伝染病の発生を減少させる。科学技術の進歩はワクチンの製造方式の革新を持ってきた。調製方式によって、現在新型ワクチンの種類はサブ単位ワクチン、結合ワクチン、合成ペプチドワクチンと遺伝子工学ワクチン(組換抗原ワクチン、組換ベクターワクチン、DNA-RNAワクチン、トランスジェニック植物ワクチン)がある。
新型コロナワクチンの研究に戻る。2020年7月14日、米Moderna社が開発した候補ワクチンmRNA-1273は100 mgの免疫量で、人体のより良い中和抗体反応とTh1CD4型細胞に偏っている免疫応答を起こし、不良反応は比較的に緩やかで、後期の臨床試験が行われている。7月20日、オックスフォード大学と軍事医学科学院の陳氏院士チームのアデノウイルスベクターワクチンChAdOx1 nCoV-19(AZD1222)II期臨床結果が発表された。エクサイティングなのは、この研究はアデノウイルスAd5ベクターの候補COVID-19ワクチンの免疫原性と安全性を評価し、次の有効性研究に候補ワクチンの適量を確定した。同じ7月20日、ドイツBioNTech社は米国ファイザーなどと共同で、RNAワクチンの1/2期臨床試験の結果をプレプリントサイトmedRxivで発表した。脂質ナノ粒子で処理されたRNAワクチンは被験者の細胞免疫応答と体液免疫応答を起こされる。研究により、BNT162b1はSARS-CoV-2棘突起タンパクの受容体結合ドメイン(RBD)をコードし、BNT162b1の発現したRBD抗原はT4繊維タンパク由来の「foldon」三量体タンパク質ドメインと融合し、多価再結合により免疫原性を増加する。
これらの成果は科学技術の発展と人類の進歩を表しているが、ワクチンの安全効用評価の過程で、ADE(antibody-dependent enhancement)効果の現れを十分に考慮しなければならない。
ADEとは何か?1964年、Hawkesなどがアルボウィルスの研究で「抗体依存性感染強化」という仮説を言及した。ADEは主にウイルスが低濃度免疫血清で複製が抑制されるのでなく、促進されることを示している。これも当初デング熱出血症とデング熱ショック症候群の主な原因である。新型コロナウイルスに対して、このような恐ろしい現象も出るか?
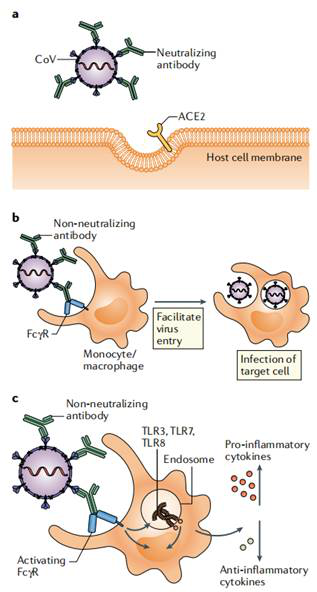
Fig6. コロナウイルス抗体反応の潜在結果
a. 抗体が介するウイルス中和過程において、ウイルススパイクタンパク質の受容体結合構造ドメイン(RBD)及びその他の構造ドメインと結合した中和抗体はウイルスが受容体ACE2に付着するのを防ぐことができる。
b. 感染した抗体依存性が増強する過程で、低品質、少量および非中和性抗体はFab構造ドメインを通してウイルス粒子と結合する。単核細胞またはマクロファージが発現したFc受容体(FcR)は抗体Fc構造ドメインと結合し、ウイルスの侵入と感染を促進する。
c. 抗体が介する免疫強化過程で、低品質、少量および非中和性抗体がウイルス粒子と結合する。Fc構造ドメインが受容体と結合した後、FcRが信号を起動し、炎症促進サイトカインが上昇し、抗炎症性サイトカインが低下する。免疫複合体とウイルスRNAはToll様受容体3(TLR3)、TLR7またはTLR8を通して信号を送り、宿主細胞を活性化させ、そして免疫病理学的現象を引き起こす。
研究によると、SARS-CoV感染で、ADEはウイルスが異なる免疫細胞(単核細胞、マクロファージ、B細胞を含む)が発現したFc受容体(FcR)と結合することにより発生される。あらかじめ存在していたSARS-CoV特異性抗体はウイルスがFcRを発現する細胞に入るのを促進する可能性がある。実際に、ADEによるマクロファージ感染は効果的なウイルスのコピーや脱落を引き起こさない。逆に、ウイルス抗体免疫複合体の内面化はFcRs5によって髄質様細胞を活性化させ、炎症や組織損傷を促進できる。この経路で入ったウイルスはパターン認識受容体TLR3、TLR7、TLR8と結合する可能性がある。マクロファージはADEを通してSARS-CoVウイルスを吸着することにより、TNFとIL-6の発生を上昇する。そのため、ワクチンの研究開発の過程で、出現可能なADE効果を考えざるを得ない。では、どのようにこの現象が人体での発生を最大限に避けるか?それはワクチンを応用する前のモデル動物での安全性検証である。
3、モデル動物はワクチンの安全性検証に応用する
薬物の開発もワクチンの研究も1つの話題を避けられない。それは臨床の体内安全と有効性の検証である。これらの検証はまたモデル動物の研究に離れられない。バイオサイエンスの発展過程を振り返ってみると、モデル動物はウニからイースト、線虫へ、現在疾患研究に広く応用されているマウスまで、長い過程を経った。人類と同族ゲノムが90%あり、且つ操作しやすいため、マウスは最良の動物モデルとなった。
新型コロナの発生以来、遺伝子編集マウスは大衆の視野に入り、伝統的な遺伝子組み換えから精確な遺伝子組み入れまで、利用可能なACE2(SARS-CoV-2ウイルスの受容体)遺伝子編集マウスが一刻も早く開発され、繁殖されている。時間が経つにつれて、さまざまな方案で編集されたマウスが徐々に登場してきた。これは疫病対抗にとって本当にエクサイティングなニュースである。
6月に、趙氏教授チームがアデノウイルスベクター新型コロナマウスモデルを作製され、実験検証したところ、この方法で作製したマウスモデルは有効な中和抗体を産生でき、ワクチンと薬物の評価に非常に重要な意義がある。同時に、ワシントン大学医学部もAdV-hACE2モデルで高効率中和抗体を調製され、7月にワクチンの研究が相次いで報告されている。米国Moderna社が開発したmRNA-1273とドイツBioNTechなどの機構が開発したナノ粒子mRNAワクチンが効果的な進展を取得し、被験者に免疫応答を与え、中和抗体を発生させた。我が国の陳氏院士チームはオックスフォード大学と共同で調製したアデノウイルスベクターワクチンChAdOx1 nCoV-19も期待される良い結果を発生した。
これらの研究何もかもモデル動物の広範な応用をもっと期待させる。疫病は私達に感銘を受けた。恐らく新型コロナウイルスほど深いものはないことである。科学技術の進歩とともに、世界の医療健康レベルは1つの新しい段階に入り、人々が生命の本質に対する理解は更に不可欠です。
参考文献:
1 Nigel J. Temperton, Paul K. Chan, Graham Simmons et al. Longitudinally Profiling Neutralizing Antibody Response to SARS Coronavirus with Pseudotypes. Emerging infectious Disease. 2005.
2 Bisht H, Roberts A, Vogel L, et al. Severe acute respiratory syndrome coronavirus spike protein expressed by attenuated vaccinia virus protectively immunizes mice. Proc Natl Acad Sci USA. 2004.
3 Yang ZY, Kong WP, Huang Y, et al. A DNA vaccine induces SARS coronavirus neutralization and protective immunity in mice. Nature. 2004.
4 Xiuyuan Ou, Yan Liu, Xiaobo Lei, et al. Characterization of spike glycoprotein of
SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nature communication. 2020.
5 Yunlong Cao, Bin Su, Xianghua Guo,et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identifified by High-Throughput Single-Cell Sequencing of Convalescent Patients’ B Cells. Cell. 2020.
6 Zhe Lv, Yong-Qiang Deng, Qing Ye, et al. Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody. Science.2020.
7 Feng-Cai Zhu, Xu-Hua Guan, Yu-Hua Li, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo controlled, phase 2 trial. The Lancet. 2020.
8 L.A. Jackson, E.J. Anderson, N.G. Rouphael, et al. An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. The new england journal of medicine. 2020.
9 Ugur Sahin, Alexander Muik, Evelyna Derhovanessian,et al. Concurrent human antibody and TH1 type T-cell responses elicited by a COVID-19 RNA vaccine. medRxiv 2020.
10 Nelson Lee, P.K.S Chan, Margaret Ip, et al. Anti-SARS-CoV IgG response in relation to disease severity of severe acute respiratory syndrome. J. Clin. Virol. 2006.
11 David J DiLillo, Peter Palese, Patrick C Wilson et al. Broadly neutralizing anti-influenza antibodies require Fc receptor engagement for in vivo protection. J. Clin. Invest. 2016.
12 Akiko Iwasaki and Yexin Yang. The potential danger of suboptimal antibody responses in COVID-19. nature ReviewsImmunology. 2020.
13 Jing Sun, Zhen Zhuang, Jian Zheng et al. Generation of a Broadly Useful Model for COVID-19 Pathogenesis Vaccination, and Treatment. Cell. 2020
14 Ahmed O. Hassan, James Brett Case, Emma S. Winkler et al. A SARS-CoV-2 infection model in mice demonstrates protection by neutralizing antibodies. Cell. 2020
15 Shi-Hui Sun, Qi Chen, Hong-Jing Gu et al. A mouse Model of SARS-CoV-2 infection and Pathogenesis. Cell host & microbe. 2020.
最新の販売促進キャンペーン:
- Cyagenノックアウトマウスライブラリ:16000種以上のKO/cKO系統マウス、3000種以上の生体マウス品系を所有、早くて2週間で納品
- コンディショナルノックアウトマウスは今なら180万円で、更に同じ遺伝子のノックアウトマウスをタダでもらえます
- Creラットの無料試用:Creモデルライブラリを設立していて、各種のラット品系が含まれます
サイヤジェン株式会社について
サイヤジェン株式会社は15年間の発展を経て、全世界の数万人の科学研究者にサービスを提供しており、製品と技術は直接にCNS (Cell、Nature、Science)の定期刊を含む5,200余りの学術論文に応用されています。弊社の「ノックアウトマウスライブラリ」は低価格だけでなく、遺伝子名称を入力すれば、ワンクリックで注文まで操作できます。 ノックアウトマウス、ノックインマウス、コンディショナルノックアウトマウス、トランスジェニックマウス、GFPマウス、免疫不全マウス、無菌マウスなどのカスタマイズサービスを提供する以外、専門的な手術疾患モデルチームがあり、多種の複雑な小動物手術疾患モデルも提供できます。
