-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
サイヤジェン株式会社のPD-L1コンディショナルノックアウトマウスは免疫、腸管微生物の研究を助力する。
腸管は人体の重要な消化吸収場所であり、最も大きな免疫器官でもある。腸管微生物群、免疫細胞と粘膜バリアから腸上皮の定常状態になり、人体健康の重要な防御線の一つである。ここで一緒にJournal of Experimental Medicineの雑誌に掲載された文献を詳しく読みます。当該研究は、小腸上皮細胞(IEC)を通じてT細胞分化(IEL、上皮内リンパ球)を調節する分子機制を初めて掲示した。また、研究によると、微生物群が小腸のMHCII、PD-L1及びIELの上皮分化にとって極めて重要であることが分かった。

小腸では、経典的CD4+-T細胞をCD4+CD8αα+上皮内リンパ球(intraepithelial lymphocytes, IELs)に分化することができるが、その周りの小腸上皮細胞(intestinal epithelial cells,IECs)の役割はまだ明確ではない。近日、Dr.Moonが率いる韓国チームの研究によると、小腸の遠端で、IECsが微生物群とIFN-γの刺激によりMHC II種の分子とプログラムされた細胞死リガンド-1(programmed death ligand-1,PD-L1)を発現し、ニッチ(niche)適応信号を提供し、CD4+CD8αα+IELs(DP IELs)の分化を促進することができる。この研究結果は最近のJournal of Experimental Medicine誌に発表された[1]。
備考:後文のSPはCD4+シングル陽性(single positive)細胞を示し、DPはCD4+CD8+ ダブル陽性(double positive)細胞を示す。
1、IELsの分化にはIECsのMHC IIの発現が必要である
IECsがDP IELsの分化過程で非典型的なAPCの役割を果たしていることを探究するために、研究者たちはC57BL/6野生型マウスの小腸の異なる部位で、MHC IIのIECsにおける発現状況を分析した。一連のフロー試験、RNA-seq実験はIECsのDP IELsの分化過程における作用がMHC II抗原提示と関連していることを示している。また、IECsが発現するMHC IIのDP IELs分化における役割を明らかにするために、研究者たちはIECsにおいて1種のMHC IIを特異的にノックアウトしたマウス(MHC II△IEC)を使用し、MHC IIfl/fl対照群のマウスに比べ、IELsの分化にIECsのMHC IIの発現が必要であることを確認した(図1G-H)。
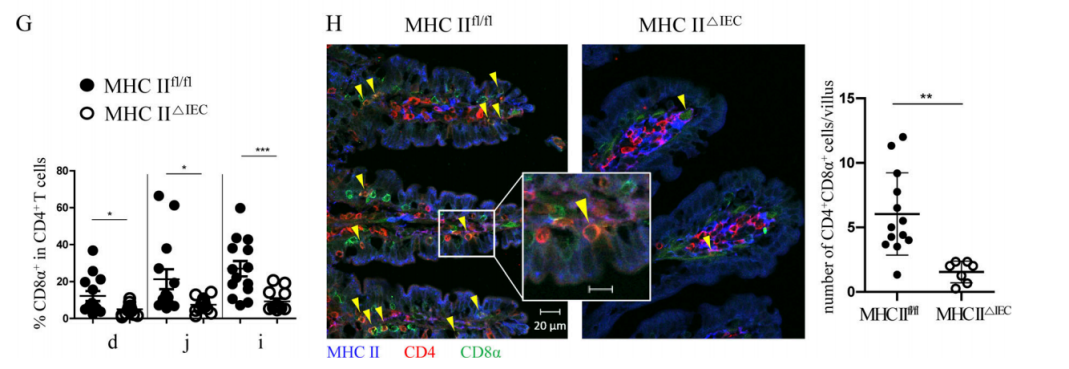
Figure 1G-H. Both flow cytometry (G) experiment and immunofluorescence experiment (H) showed: the proportion of DP IELs in SP IELs cells decreased significantly in MHC II△IEC mice, compared with the MHC IIfl/fl mice. Immunofluorescence experiment (H) also showed: the majority of DP IELs contacts the base lateral surface of epithelial cells with highly-expressed MHC II.
2、MHC IIのIECsにおける発現はIFN-γの存在に依存する
IFN-γが非造血細胞(IECsなど)でMHC IIの発現を強く誘導できるという報道がある。この結論をさらに検証するために、研究者たちはIFN−γ受容体をノックアウトしたマウス(IFN-γR−/−)を使用した。結論は先人の実験結果と一致している。IFN-γR−/−マウスのIECsで、MHC IIの発現が検出されておらず、DP IELsの分化がひどく妨害され、SP T細胞における割合はほとんど0(図2A)である。野生型マウスにおいて、anti-IFN-γ抗体を添加した後、MHC IIの発現レベルもSP IELs細胞におけるDPの割合も著しく低下する(図2B)。さらに、IFN−γはDP IELsの分化に必要なものであるという報道がある。これは、転写因子T−betの発現を誘導することによって、DP IELsの分化を促進することができる。IFN−γがDP IELsの機能成熟において重要な役割を果たしていることを示している。
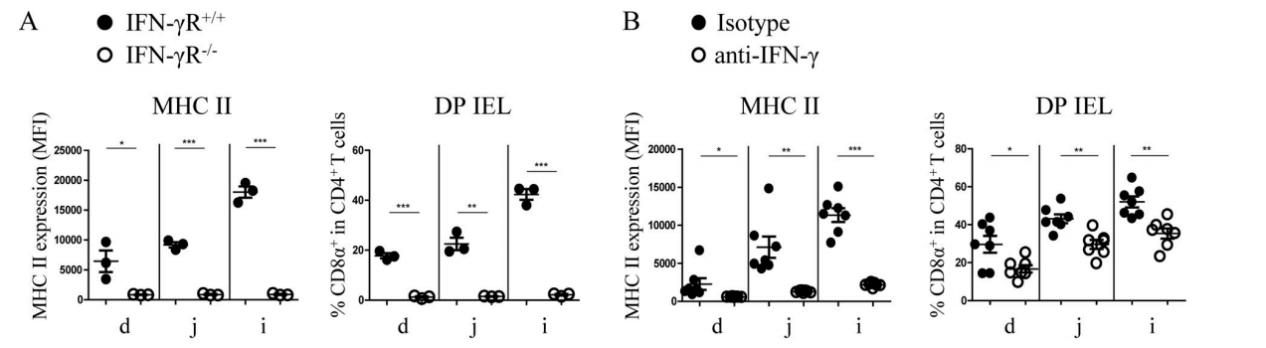
Figure 2. IFN-γ can strongly induce the expression of MHC II in non-hematopoietic cells (such as IECs).
IELsとIECsでIFN-γがDP IELs分化に与える影響を探究するために、研究者たちは骨髄(Bone marrow,BM)キメラマウスを作製した。ドナーマウスの足骨からBM細胞を取って、静脈注射で致死線量の照射を受けたマウスの体内(ドナーマウスの造血細胞→受けマウス)に注入し、8週間の造血再構築の後にマウスを殺す。その結果(図2C):造血細胞(CD4+IELsなど)と非造血細胞(IECsなど)のいずれも、DP IELsの分化には完全なIFN−γR信号が必要である。また、以前に野生型マウスで観察された異なる小腸部位におけるMHC IIの発現量とDP IELsの比率の明らかな差異はBMキメラ型マウスで観測されなかった。これは免疫再構築後のマウスが安定状態よりもIFN-γが多く発生したためではないかと研究者たちは推測されたが、これは腸の微小環境を変えて炎症を起こし、このような地域的な違いを解消した。
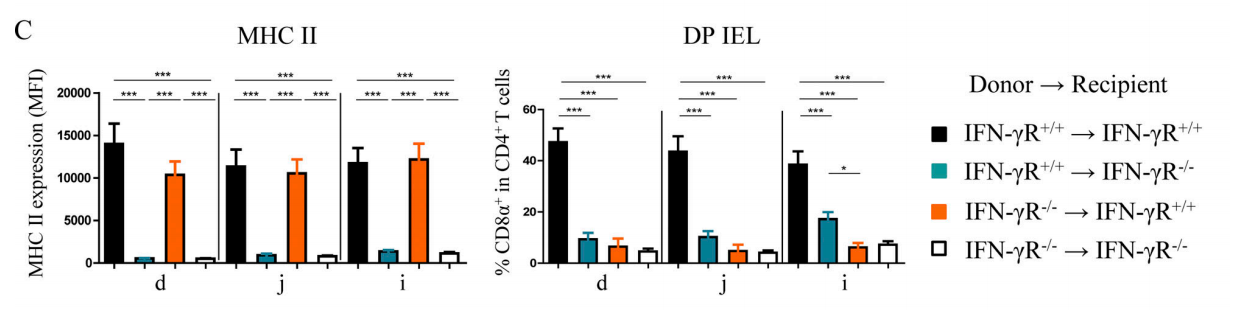
Figure 2C. Complete IFN-γR signals are indispensable for differentiation of DP IELs.
MHC II+IECsがDP IELs分化において非典型的なAPCの役割を果たしているかを直接的に探究するために、研究者たちはIFN-γR+/+マウスとIFN-γR−/−マウスから由来する小腸オルガノイド(orgnoids)をそれぞれ構築した。彼らはまずIFN-γがオルガノイドで体内と一致する効果を発揮することを検証された。IFN-γはオルガノイドでIECsのMHC IIの発現を強力に誘導できる(図2D-E)。また、T-box expressed in T cells (T-bet)はDP IELsの分化過程において重要な上流制御因子であり、Runx3の発現を誘導してThPOKの発現を抑制することができるという研究結果がある。T-betの誘導で産生したサイトカイン(IFN-γなど)は腸内の微小環境刺激因子の存在でDP IELsの分化をさらに促進することができる。そのため、研究者たちは、腸内の微小環境刺激因子TGF-βとレチン酸(Retinoic acid, RA)が存在する場合、IFN-γと卵白アルブミンポリペプチド(ovalbumin peptide,OVAp)によって予備刺激された小腸オルガノイドと、anti-CD3ε/CD28によって予備刺激されたOVA特異性CD4+T細胞(OT-II)を24h培養する(図2F)。その結果、IFN-γはMHC IIの大量発現を誘導することができ、MHC II+IECsはDP IELs分化において非典型的なAPCの役割を果たし、TGF-βとRA刺激はさらにDP IELsの分化を促進することができる。
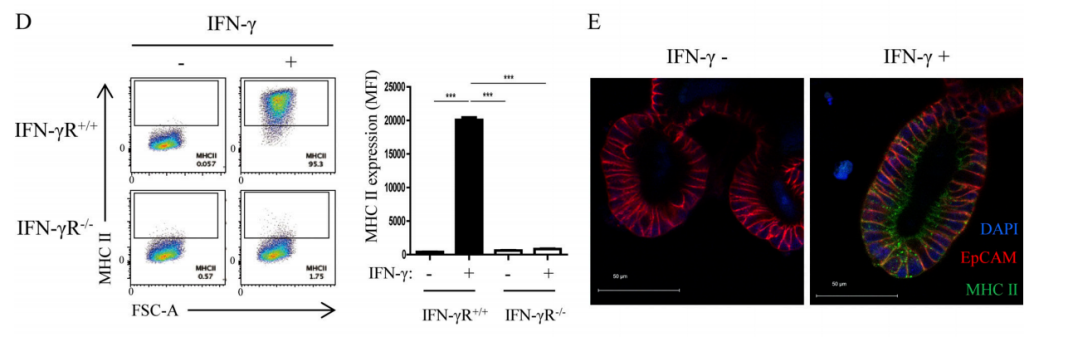
Figure 2D-E. Flow cytometry (D) and immunofluorescence experiments (E) showed that after IFN-γ stimulation, the expression level of MHC II on the organoids IECs derived from IFN-γR+/+ mice increased significantly, while MHC II expression was not available on the organoids IECs derived from IFN-γR−/−mice.
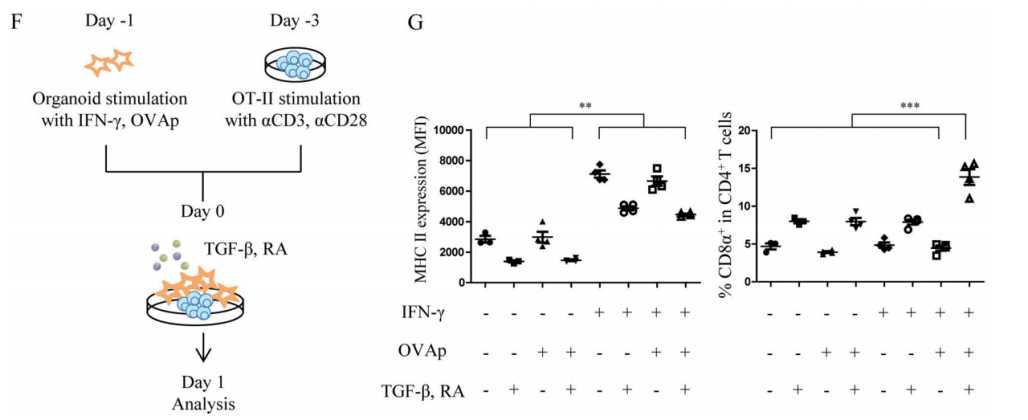
Figure 2F-G. Co-culture experiment (F); MHC II expression on IECs (G left); DP ratio in SP OT-II cells (G right).
3、IECsでIFN-γの誘導により生成されたPD-L1はDP IELs分化において重要な役割を果たす
上記の実験によって、MHC II+IECsがAPCとしてCD4+IELsを同源刺激することができることが分かった。研究者たちはそれらがMHC IIと一緒にT細胞の受容体を調整することができると推測している。また、MHC IIのIECsにおける発現はIFN-γの存在に依存しているので、これらの共受容体はIECsのIFN-γ信号に関連していると研究者たちはさらに推測された。IFN-γで処理した小腸オルガノイド或いは処理していない小腸オルガノイドに対してRNA-seq分析を行い、研究者たちはPD-L1タンパクをコードするCd274がMHC IIに関連する遺伝子の発現と著しく相関していることを発見された(図3A-B)。オルガノイド実験(図3C)と体内実験(図3D-E)はいずれもIFN-γがPD-L1の発現量に著しく影響すると示している。DP IELsの分化にIECsのPD-L1の発現が必要であることをさらに確認するために、研究者たちは、PD-L1ノックアウトマウス(PD-L1−/−)、RAG−1ノックアウトマウス(RAG-1−/−。マウスは成熟したT、B細胞がない)、IECsで特異的にPD−L1をノックアウトしたマウス(PD-L1△IEC)、及びサイヤジェン株式会社が作製したPD-L1fl/flの対照を使用した。一連の実験結果(図F−H)は、DP IELs分化においてIECsのPD−L1が重要な役割を果たしていることを示している。
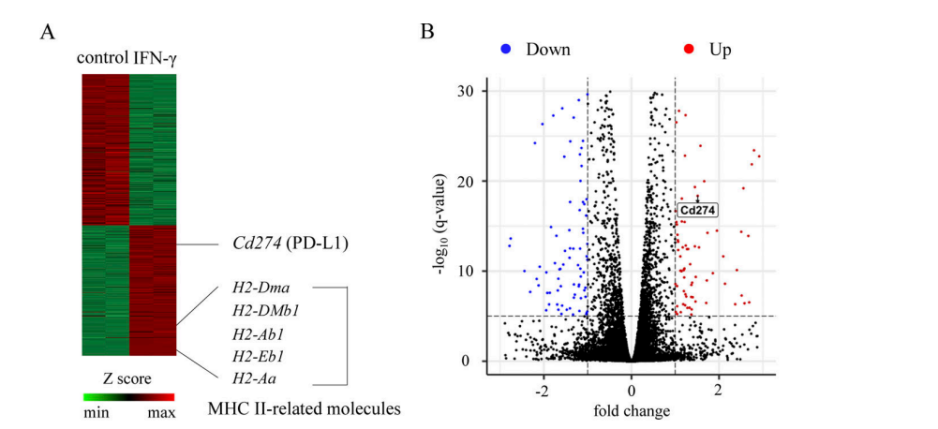
Figure 3A-B. Heatmap of differentially expressed genes (A) and volcano plot (B).
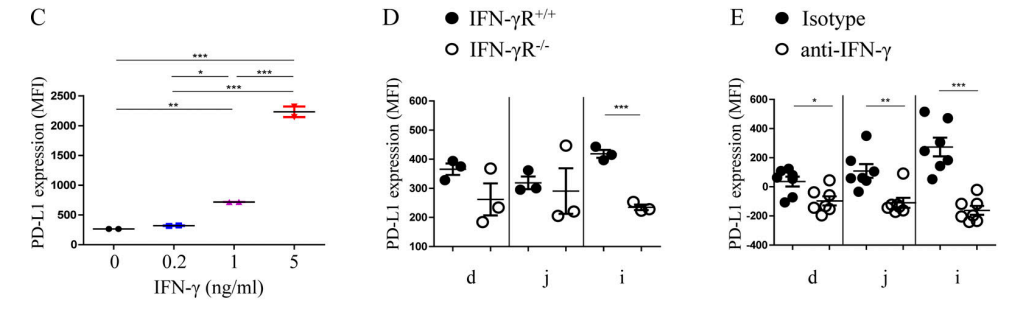
Figure 3C-E. (C) The expression quantity of PD-L1 in small intestinal organoids after IFN-γ treatment at varying concentrations; (D) The expression quantity of PD-L1 in IFN-γR−/−mice decreased significantly compared with IFN-γR+/+mice; (E)The expression quantity of PD-L1 on IECs decreased significantly after injection of anti-IFN-γ antibody in IFN-γR+/+mice.
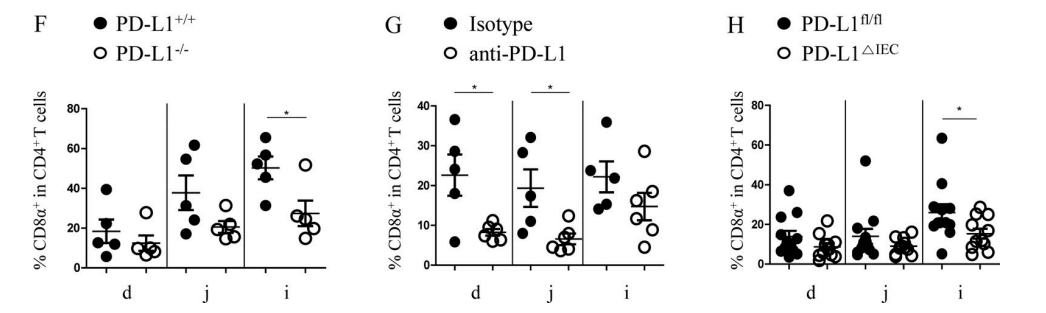
Figure 3F-H. (F) Compared with PD-L1+/+mice, the proportion of DP IELS decreased significantly in the ileum of PD-L1−/−mice; (G) After RAG-1−/− mice were injected with splenic CD4+ T cells, and DP IELs development were inhibited by anti–PD-1 treatment; (H) Compared with PD-L1fl/fl mice, the proportion of DP IELS decreased significantly in the ileum of PD-L1△IEC mice.
4、微生物群は小腸におけるMHC IIとPD-L1の発現及びDP IELsの分化に極めて重要である
小腸におけるIFN-γの発生及びIECsのMHC IIの発現に微生物群が必要であるという報道がある。IECsのPD-L1の発現が微生物群によって調節されているかを探究するために、研究者たちは無菌(Germ-free,GF)マウス、特定病原体がない(specific pathogen–free,SPF)マウスを使って実験を行った。これらの実験結果は、微生物群が誘導したIFN−γがIECsを刺激してMHC IIとPD−L1を生成し、この両者はDP IELsの分化を調節することができることを示している。
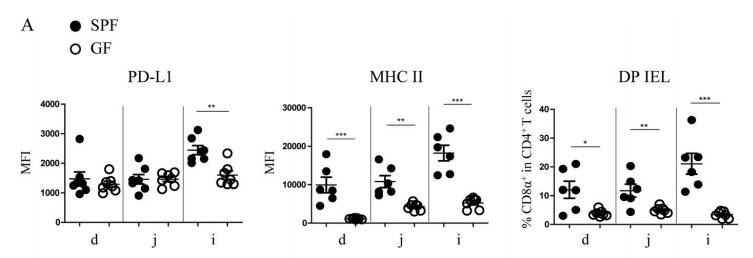
Figure 4A. Compared with SPF mice, the expression level of PD-L1 on IECs of GF mice decreased significantly in ileum, while the expression quantity of MHC II and the proportion of DP IELs decreased significantly in various areas of small intestine, especially in ileum.
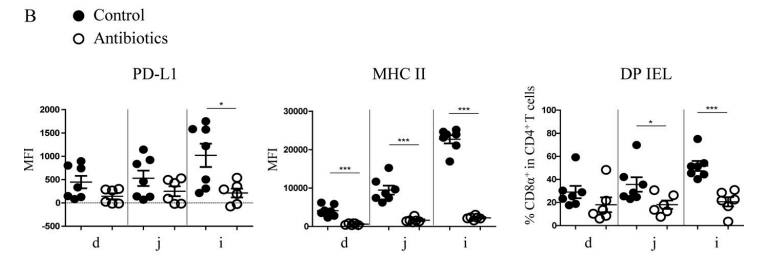
Figure 4B. After antibiotic treatment, the expression level of PD-L1 on IECs of SPF mice decreased significantly in ileum, and the expression quantity of MHC II and the proportion of DP IELs decreased significantly in various areas of small intestine, especially in ileum.
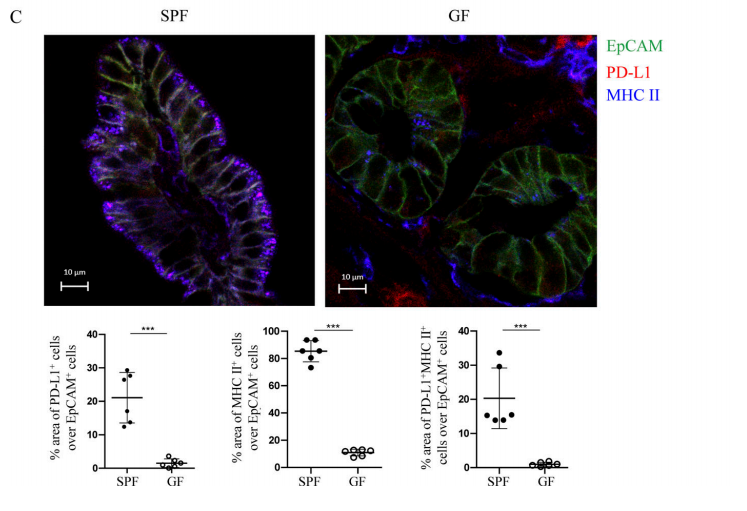
Figure 4C. According to immunofluorescence experiment, most IECs in the ileum of SPF mice expressed MHC II, and 20% expressed PD-L1, while in GF mice, the expression of MHC II and PD-L1 were significantly reduced.
5、PD−1信号は、ThPOKの発現を抑制することによってDP IELsの分化を刺激する
経典的CD4+T細胞とCD8+T細胞はそれぞれT helper–inducing POZ/Krüppel-like factor(ThPOK)とrunt-related transcription factor 3(Runx3)を発現することによって自身の家系を維持する。したがって、DP IELsの分化には、Runx3の発現量の引き上げとThPOKの欠失が必要である。さらに、IECsのMHC IIおよびPD−L1の発現は、DP IELsの分化に極めて重要である。これはTCRおよびPD−1の放出信号はCD4+IECsの細胞再プログラムに参与している可能性があることを示している。前期の実験結果はT細胞の内因性のPD-1信号がDP IELsの分化にとって必須であることを示した(図5A−C)。その中の分子メカニズムをさらに探究するために、研究者たちはThPOK-GFPレポーターマウスを使用した。実験結果は、PD-1がThPOK発現の抑制とDP IELsの分化にPD−1信号が必要であることを示している(図5D-E)。また、体外実験結果(図5G-I)は、PD−1信号が、経典的Src homology 2 domain–containing tyrosine phosphatase (SHP)通路を通してCD4+IECsのThPOKの発現を低減し、DP IELsの分化を促進する。
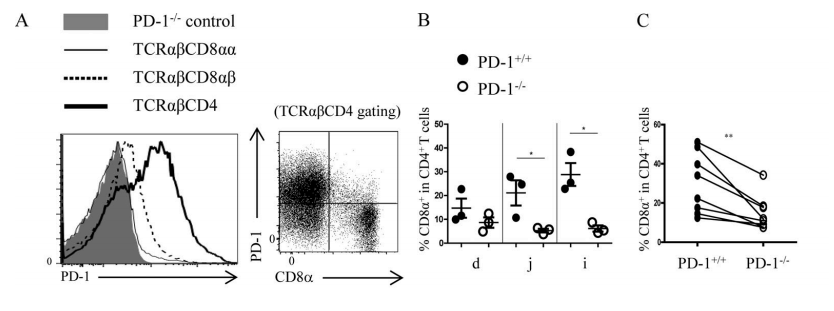
Figure 5A-C. (A) The expression of PD-1 in different IEL subgroups in C57BL/6 wild-type mice. When SP IELs differentiated into DP IELs, the PD-1 expression decreased. (B) Compared with PD-L1+/+ mice, the proportion of DP IELs decreased significantly in the small intestines of PD-L1−/− mice. (C) After 1:1 mixing splenic CD4+T cells from PD-L1+/+ and PD-L1−/− mice, they were transplanted into RAG-1−/− recipient mice. The proportion of DP IELs from PD-L1−/− CD4+ T cells decreased significantly.
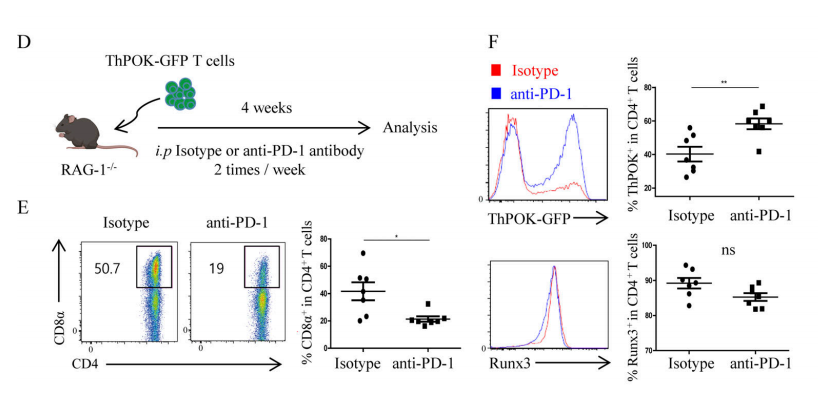
Figure 5D-F. (D) Experimental diagram. Splenic T cells from ThPOK-GFP reporter mice were transplanted into RAG-1−/−recipient mice, and anti-PD-1 antibody treatment was carried out on the recipient mice during the reconstruction period, (E) The expression levels of ThPOK and Runx3; (F) The proportion of DP IELs.
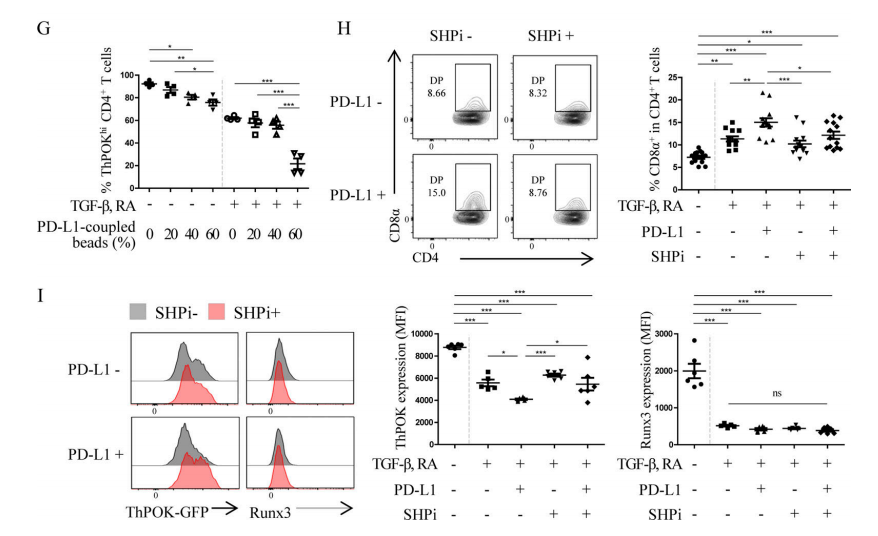
Figure 5G-I. (G) After in vitro co-culture of CD4+T cells, TGF-β, RA, and PD-L1 for 3 days, the proportion of ThPOKhi cells was determined. PD-L1 mediated the down-regulation of ThPOK expression. (I-H) After in vitro co-culture of CD4+T cells, TGF-β, RA, PD-L1 and SHP inhibitor (SHPi) for 3 days, the proportion of DP IELs and the expression levels of ThPOK and Runx3 were determined.
要約すれば、この文章で、IECsは腸内でDP IELsの分化を促進する重要なコントロール要因であり、非典型的なAPCの役割を果たしていることがわかった。腸内微生物群から発生するIFN-γは、IECsを刺激することによりMHC IIとPD-L1を発現し、SP IELsにTCR刺激と共受容体信号を提供し、DP IELsへの分化を促進することができる。また、研究者たちはまた、異なる生理位置のIECsの遺伝子発現パータンに違いがあり、その周りの組織常駐型免疫細胞(例えば、DP IELsの分化)にも影響を与えると発見された。
備考:文中のすべてのマウスはバックグラウンドがC57BL/6である。
人体の腸管微生物ゲノムは人類の第2セットのゲノムとして、人類の健康と密接に関連している。大量の研究は腸管微生物が心血管、腫瘍、免疫、神経、消化等を含む多種類の疾患の発生発展と密接に関連していることを示し、その因果関係も徐々に解明していく。サイヤジェン株式会社のオールインワンの革新的なCROプラットフォームは文中の遺伝子改変マウス、無菌マウス、無菌マウス技術サービスを提供し、動物モデルの多種類のニーズを満たします。ご興味をおもちいただけましたら、カスタマイズ作製しますのでお気軽にお問い合わせください。
ノックアウトマウスライブラリ:16000系統以上のKO/cKOマウスは在庫状態がワンクリックで検索でき、最短2週間で納品致します。
成体KOマウスとcKOマウスのフラッシュセール:毎週更新で、定期に検索してご関心のある遺伝子を探しましょう。
原文検索:
[1]Moon S , Park Y , Hyeon S , et al. Niche-specific MHC II and PD-L1 regulate CD4+CD8αα+ intraepithelial lymphocyte differentiation[J]. Journal of Experimental Medicine, 2021, 218(4).
DOI:10.1084/jem.20201665
サイヤジェン株式会社について
サイヤジェン株式会社は15年間の発展を経て、全世界の数万人の科学研究者にサービスを提供しており、製品と技術は直接にCNS (Cell、Nature、Science)の定期刊を含む5,200余りの学術論文に応用されています。弊社の「ノックアウトマウスライブラリ」は低価格だけでなく、遺伝子名称を入力すれば、ワンクリックで注文まで操作できます。 ノックアウトマウス、ノックインマウス、コンディショナルノックアウトマウス、トランスジェニックマウス、GFPマウス、免疫不全マウス、無菌マウスなどのカスタマイズサービスを提供する以外、専門的な手術疾患モデルチームがあり、多種の複雑な小動物手術疾患モデルも提供できます。
