-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
遺伝子は眼疾患の発症に重要な役割を果たしますが、そのうちのいくつかは子供や大人に非常に多く見られます。小児期失明の60%以上は、眼球奇形、視神経萎縮、網膜色素変性症などの遺伝的要因によるものです。成人では、緑内障や黄斑変性症などの深刻な眼病にも遺伝的要因が関連している可能性があります。
過去15年間のげっ歯類モデル作製におけるサイヤジェンの経験を振り返ると、ヒトの眼疾患によく関連する遺伝子変異のマウスモデルを数多く開発してきました。例えば、網膜色素変性症の研究には、Rhoノックアウト(KO)マウスが使われています。また、サイヤジェンは、遺伝子に基づく眼疾患の研究など、疾患研究にとって重要性が増しているヒト化マウスモデルの開発を続けています。以下では、眼疾患や眼科研究に最も関連性の高いヒト化マウスモデルをご紹介します。
網膜色素変性症(RP)とは?
網膜色素変性症(RP)は、臨床的にも遺伝的にも異質な失明性網膜疾患であり、遺伝性の網膜変性疾患カテゴリーに属し、これまでに54の網膜遺伝子の変異が発見されています[1]。RPは、杆体視細胞疾患による進行性の夜盲症から始まり、徐々に周辺視野が失われ、次いで錐体視細胞変性による完全失明を引き起こします。
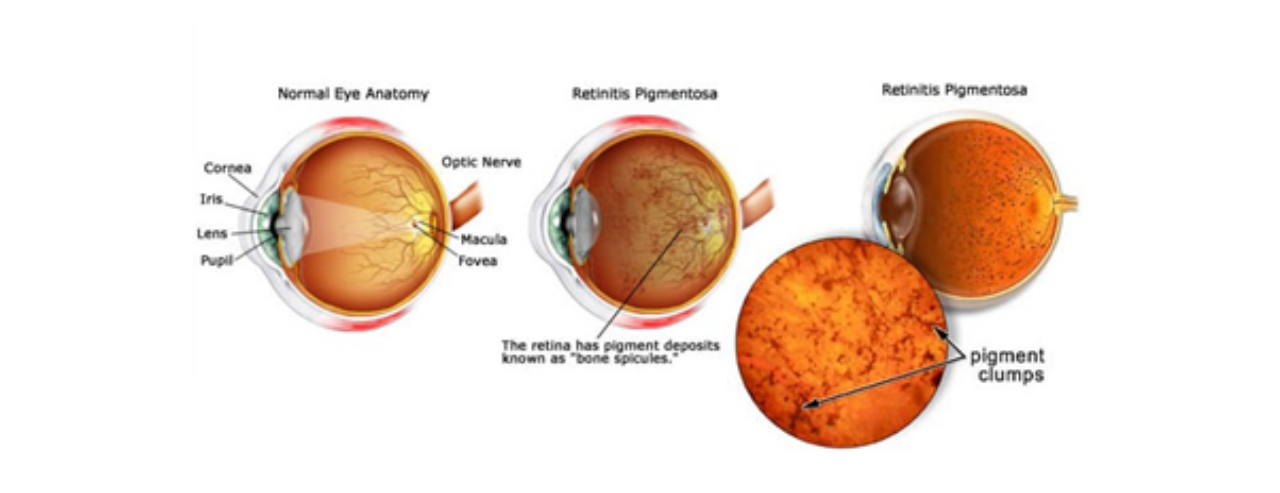
図1. 網膜色素変性症とは? (出所:Fleetwood Family Eye Care)
網膜色素変性症は、全世界で3500人に1人の割合で発症し、常染色体優性遺伝(adRP)、常染色体劣性遺伝(arRP)、X連鎖遺伝(XlRP)、二遺伝性遺伝[2]などがあるとされています。現在までに、adRPの原因遺伝子は少なくとも20個同定されており、それらのタンパク質産物は、外節円盤形成、光シグナル伝達と視物質再生経路、遺伝子発現、転写、mRNA処理など、網膜光受容体の構造や代謝の多様で重要な局面に関与していることが示唆されています[3]。
|
タイプ |
マッピングされた遺伝子座(未同定) |
同定された遺伝子 |
|
常染色体優性網膜色素変性症(adRP) |
RP63 |
ADIPOR1, ARL3, BEST1, CA4, CRX, FSCN2, GUCA1B, HK1, IMPDH1, IMPG1, KIF3B, KLHL7, NR2E3, NRL, PRPF3, PRPF4, PRPF6, PRPF8, PRPF31, PRPH2, RDH12, RHO, ROM1, RP1, RP9, RPE65, SAG, SEMA4A, SNRNP200, SPP2, TOPORS |
|
常染色体劣性網膜色素変性症 (arRP) |
RP22, RP29 |
ABCA4, AGBL5, AHR, ARHGEF18, ARL6, ARL2BP, BBS1, BBS2, BEST1, C8orf37, CERKL, CLCC1, CLRN1, CNGA1, CNGB1, CRB1, CWC27, CYP4V2, DHDDS, DHX38, EMC1, ENSA, EYS, FAM161A, GPR125, HGSNAT, IDH3B, IFT140, IFT172, IMPG2, KIAA1549, KIZ, LRAT, MAK, MERTK, MVK, NEK2, NEUROD1, NR2E3, NRL, PCARE, PDE6A, PDE6B, PDE6G, POMGNT1, PRCD, PROM1, PROS1, RBP3, REEP6, RGR, RHO, RLBP1, RP1, RP1L1, RPE65, SAG, SAMD11, SLC7A14, SPATA7, TRNT1, TTC8, TULP1, USH2A, ZNF408, ZNF513 |
|
X連鎖性網膜色素変性症 (XlRP) |
RP6, RP24, RP34 |
OFD1, RP2, RPGR |
表1. 網膜色素変性症(RP)の遺伝子マッピングとと同定 [1]
(出所: RetNet, the Retinal Information Network)
Haimらの研究によると、adRP型の有病率は非定型RP全体で8.4%、arRPは19%、X-linkedは14.3%であることが明らかになっています[4] [5]。adRPの原因となる最も一般的な単一遺伝子はロドプシン(RHO; MIM# 180380)で、これまでに130以上の変異が同定されており、症例の8~10%を占めています[6] [7]。
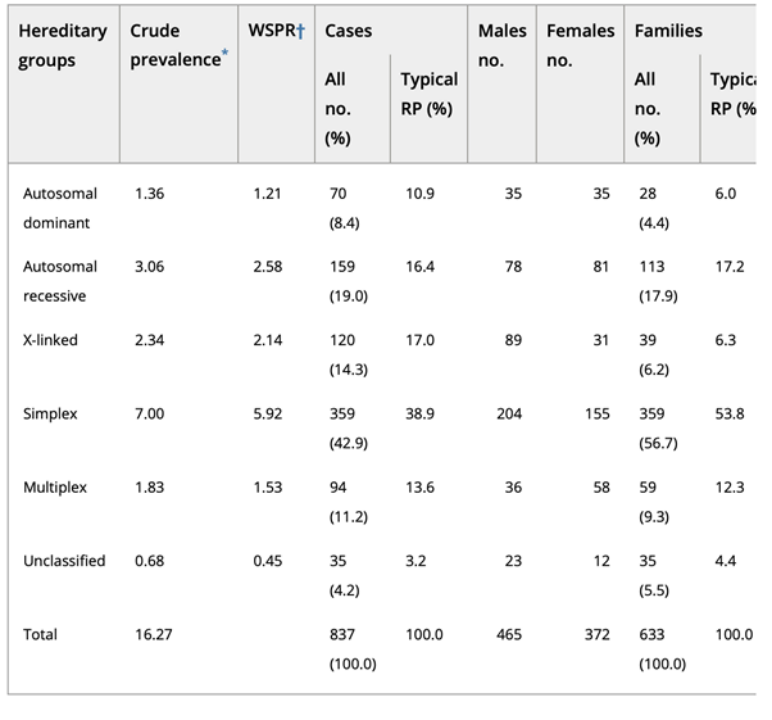
表2. 網膜色素変性症(RP)における遺伝性群の分布[4]
RHO遺伝子の概説
RHO (ロドプシン) はタンパク質をコードする遺伝子です。RHO遺伝子にコードされるロドプシンタンパク質は、目の奥にある杆体細胞に存在し、低照度下での視力に不可欠です。杆体は、目の奥にある光に敏感な組織(網膜)の一部として、低照度環境での視力を提供しています。網膜にある他の光受容細胞は錐体と呼ばれ、明るい光(高輝度)の中での視力を担っています。ロドプシンタンパク質(RHO)は、ビタミンAの一種である11-cisレチナールという分子に結合しています。この分子(11-cisレチナール)に光が当たると、ロドプシンが活性化して一連の化学反応が起こり、電気信号が生成されます。この信号が脳に伝達され、視覚として解釈されます。
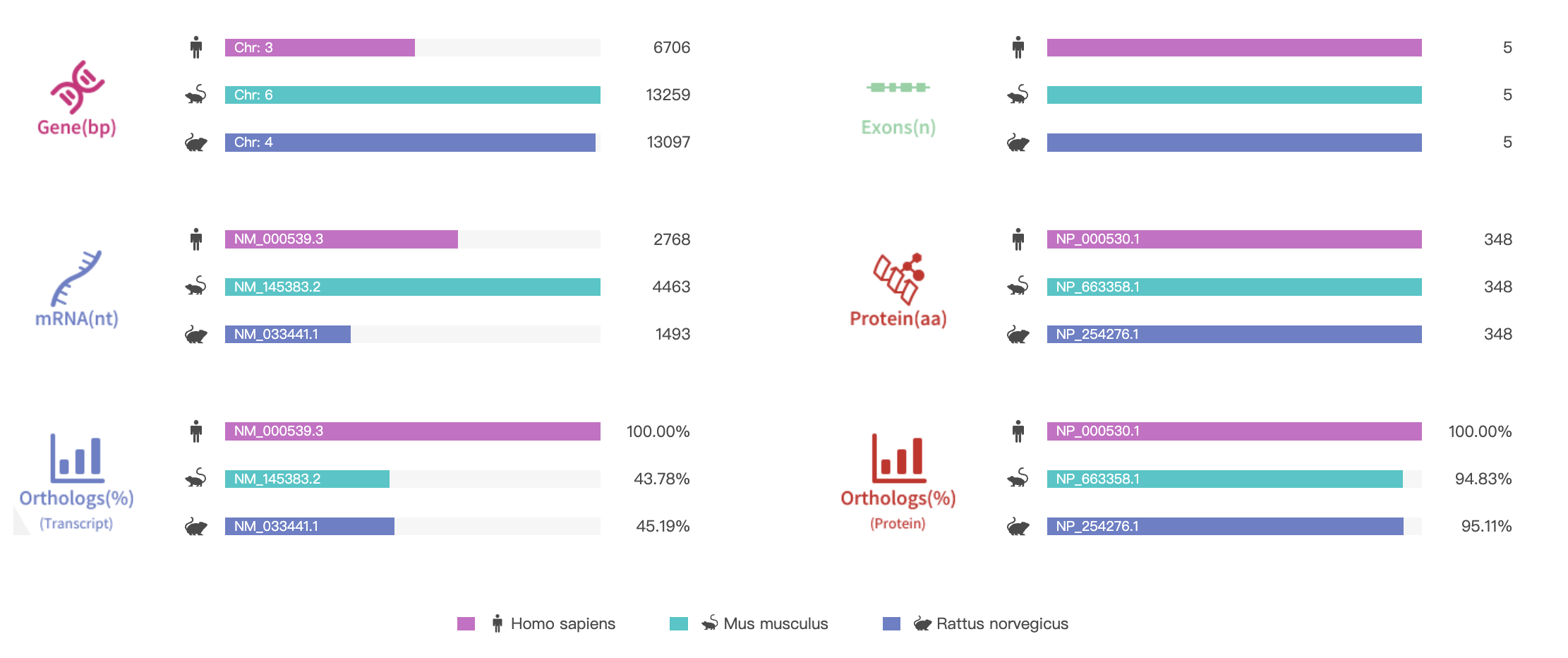
図2 RHOの遺伝子情報と配列相同性アラインメント [8]
常染色体優性網膜色素変性症(ADRP)とRHO遺伝子
網膜色素変性症(RP)の患者において、RHO遺伝子に150以上の変異があることが確認されています。RHO遺伝子の変異は、この疾患の最も一般的な形態と考えられている常染色体優性遺伝の全症例の20~30%を占めています。まれに、RHO遺伝子の変異が常染色体劣性RPに関連することがあります。しかし、この疾患は通常、他の遺伝子の変異に起因するものです。
RPの原因となるRHO遺伝子変異の多くは、ロドプシンタンパク質の折りたたみまたは輸送に変化を与えています。また、少数の突然変異は、光に反応してロドプシンが活性化されるのではなく、恒常的に活性化されるようになります。ロドプシンの変異が細胞の必須機能を阻害し、杆体の自己破壊(アポトーシス)を引き起こすことが研究により示唆されています。杆体は低照度下での視力に不可欠であるため、RP患者ではこれらの細胞の喪失により、進行性の夜盲症が引き起こされます。
網膜色素変性症は、明るい場所で視覚を提供する錐体細胞が徐々に失われることも関連しています。錐体細胞の死はトンネル視を引き起こし、多くの患者では最終的に失明に至ります。RHO遺伝子の変異が錐体細胞の機能や生存にどのような影響を及ぼすかはまだ明らかにはなっていません。
ヒト化RHOマウスモデル
ADRPにつながるRHO変異は100以上あり、北米で最も多く見られるRHO変異はP23H(プロリン23をヒスチジンに置換)です。これは最初に同定されたRP変異であり、in vitroおよび動物モデルの両方で広範囲に研究されています。近年、ヒトを危険にさらすことなくCRISPR/Cas9の治療効果をin vivoで前臨床試験できるRHOヒト化マウスモデル(例:T17M、P23Hなど)がいくつか作製されています。しかし、既知のRHO変異の数に比べ、利用可能なヒト化マウスは少ない上、変異ごとに対応したヒト化マウスの作製には時間とコストがかかります。
あるケースでは、Xiaozhen LiuらはCRISPR/Cas9と組み合わせた相同性指向性修復戦略(HDR)を用いて、開始コドン後のマウスエキソン1(mE1)を停止コドン前のmE5と置き換え、すべてのイントロンをヒト対応するものに置き換えたヒトRHOゲノム断片を導入しています。ヒトロドプシンは、in vivoで内在性マウスプロモーターの制御下で転写的にも翻訳的にも自己発現することができました。ヒト化マウスの変異していないヒトロドプシンは、形態的にも機能的にもマウスのロドプシンに取って代わることができました。しかし、T17M、G51D、G114R、R135W、P171Rの変異を同時に含むヒトロドプシンを変異型ヒト化マウス(Mut-Rhowt/humおよびMut-Rhohum/hum)に入れると、網膜変性が引き起こされました [10]。
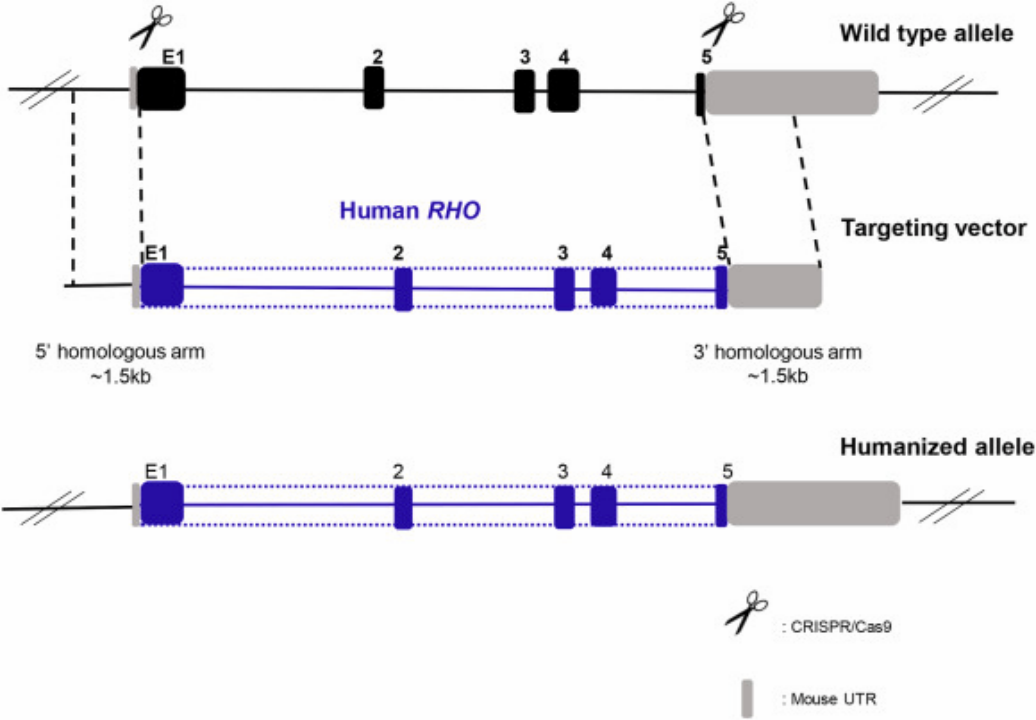
図3. ヒト化RHOマウス作製戦略 [10]
Mut-Rhohum/humマウスは、杆体外節の形成不全を伴う重度の網膜変性を起こし、3ヶ月後には網膜電図(ERG)が記録されなくなりました。Mut-Rhowt/humマウスは、視細胞の減少速度が緩やかでした。7ヶ月齢のMut-Rhowt/humマウスでは、同年齢のWTマウスと比較して、暗所視ERG反応の低下が見られたが、3ヶ月以降には外節の短縮と外核層の薄化が観察されるようになりました。7ヶ月から9ヶ月の間、Mut-Rhowt/humマウスでは、暗所視ERG応答の著しい異常が見られ、視細胞の損失も明らかでした。12ヶ月齢のMut-Rhowt/humマウスでは、低下した暗所および明所ERG応答と網膜全体の変性が観察されました。
今回紹介した「変異体ヒト化ヘテロ接合体戦略」は、前臨床試験において、これら5つの変異に対するCRISPR/Cas9による遺伝子編集療法を、時間短縮と費用対効果の高い方法で検討する機会を提供するものです。
サイヤジェンが提供するサービスとは?
サイヤジェンは、過去1年間、眼科用遺伝子治療モデル開発プラットフォームの構築に注力してきました。当社は眼疾患モデルの作製から、AAV注入、in vitroおよびin vivoでの薬物動態評価まで、前臨床眼科疾患研究のためのワンストップソリューション提供を目指しています。
サイヤジェン・ノックアウトマウス用カタログライブラリ
サイヤジェン・ノックアウトマウス用カタログライブラリでは、数千の遺伝子ノックアウト(KO)マウスとコンディショナルノックアウト(cKO)マウスをご用意しています。すぐご利用いただけるRho動物モデルや、カスタム動物モデルの作製が可能です。cKOマウスやKOマウスをお探しの場合、今季の最新キャンペーンをお見逃しなく!cKOをご購入いただくと、KOマウスを無償で贈呈いたします!
次の研究のためのモデル構築戦略の策定について、ぜひ当社の専門家にご相談ください。
上図より詳細をご確認いただけます
参考文献:
[1] RetNet. Available at: http://www.sph.uth.tmc.edu/Retnet. Accessed October 2015.
[2] Rivolta C, Sharon D, DeAngelis MM, Dryja TP. Retinitis pigmentosa and allied diseases: numerous diseases, genes, and inheritance patterns. Hum Mol Genet. 2002 May 15;11(10):1219-27. doi: 10.1093/hmg/11.10.1219. Erratum in: Hum Mol Genet. 2003 Mar 1;12(5):583-4. PMID: 12015282.
[3] Hims MM, Diager SP, Inglehearn CF. Retinitis pigmentosa: genes, proteins and prospects. Dev Ophthalmol. 2003;37:109-25. doi: 10.1159/000072042. PMID: 12876833.
[4] Haim M. x. 2002;(233):1-34. doi: 10.1046/j.1395-3907.2002.00001.x. PMID: 11921605.
[5] Wright AF, Chakarova CF, Abd El-Aziz MM, Bhattacharya SS. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nat Rev Genet. 2010 Apr;11(4):273-84. doi: 10.1038/nrg2717. PMID: 20212494.
[6] Briscoe AD, Gaur C, Kumar S. The spectrum of human rhodopsin disease mutations through the lens of interspecific variation. Gene. 2004 May 12;332:107-18. doi: 10.1016/j.gene.2004.02.037. PMID: 15145060.
[7] HGDB-Cardiff. Available at: http://www.hgmd.org. Accessed October 2015.
[8] RDDC. Available at: https://rddc.tsinghua-gd.org/details/gene?gene=xnEBPG.
[9] GeneCards. Available at: https://www.genecards.org
[10] Xiaozhen Liu, Ruixuan Jia, Xiang Meng, Ying Li, Liping Yang,
Retinal degeneration in humanized mice expressing mutant rhodopsin under the control of the endogenous murine promoter, Experimental Eye Research, Volume 215, 2022, 108893, ISSN 0014-4835, https://doi.org/10.1016/j.exer.2021.108893.

