-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
キメラ抗原受容体T細胞(CAR T細胞)とは、免疫療法に用いるT細胞の受容体を遺伝子操作により人工的に作り出したT細胞です。キメラ抗原受容体(CAR)とは、T細胞に特定の抗原を標的とする新たな能力を持たせるために遺伝子操作された受容体タンパク質のことです。CAR T細胞療法は、CARを導入したT細胞をがん治療に用いられています。科学者たちは、人からT細胞を採取し、遺伝子組み換えを行い、得られたCAR T細胞を患者に注入し、腫瘍を攻撃させます[1] 。同細胞療法では、主要組織適合遺伝子複合体(MHC)の制約を受けずに、標的抗原に結合することで活性化し、腫瘍細胞を効率的に殺傷することができます。
現在、CAR T細胞療法は、血液悪性腫瘍において前例のない成功を収めています。前回は、固形腫瘍研究における本療法の課題を概観しましたが、本日は、CAR T細胞療法のキーポイントであるCARの構造と設計について解説していきます。
CAR構造
CARは、主に細胞外ドメイン、膜貫通ドメイン、細胞内ドメインの3つの部分から構成されています(図1)。細胞外抗原結合ドメインは、通常、抗体由来の単鎖可変フラグメント(scFv)であり、主に抗体の可変軽鎖(VL)と可変重鎖(VH)、および中間部の柔軟なリンカーで構成されています。抗原結合ドメインはヒンジ領域を介して膜貫通ドメインと連結しており、腫瘍抗原を特異的に認識することができます。膜貫通ドメインの主な機能は、CARを細胞膜上に固定することであり、CARの発現レベルの安定性に重要な役割を果たします。細胞内ドメインには、共刺激ドメインとシグナル伝達ドメインがあり、いずれもT細胞の完全活性化に寄与しています。以下、CARの各構成要素について詳細に紹介します。
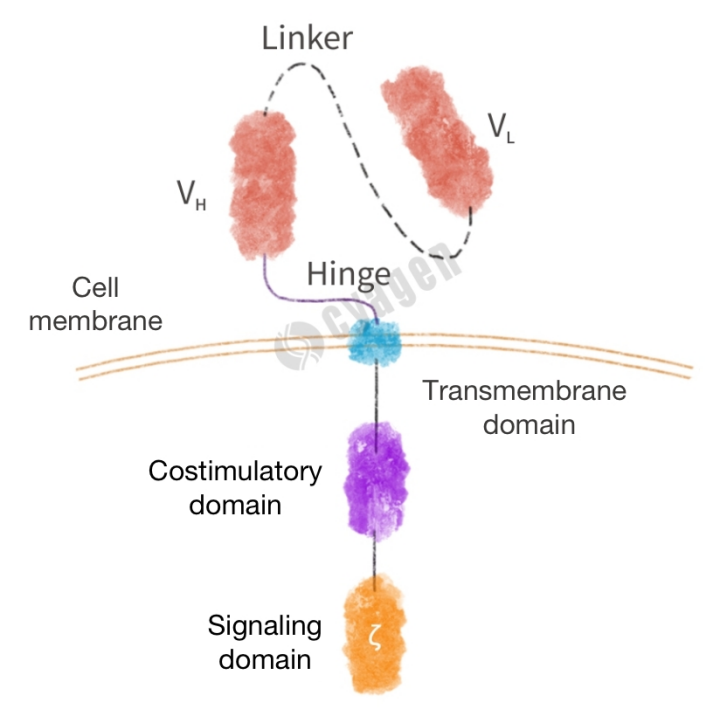
図1. CARの分子構造図
細胞外ドメイン
抗原結合ドメイン
腫瘍抗原を標的とするscFvの特異性と親和性は、CAR-T療法の安全性と有効性の基礎となるものです。腫瘍関連抗原(TAA)は、免疫療法の主要な標的であり、腫瘍組織で高発現し、正常組織では低発現します。このため、オフターゲット(On-target)、腫瘍外(Off-tumor)の組織へのダメージ、さらには生命を脅かすような毒性につながる可能性があります。したがって、CAR設計におけるscFvの特異性は極めて重要です。オフターゲット、腫瘍外への副作用を避けるためには、抗体の特異性研究が非常に重要です。
scFvの親和性は、複数の受容体-リガンド相互作用を占め、CARの機能を根本的に決定する抗原結合ドメインにおいて、特に重要な変数です。CARが腫瘍細胞上の抗原を認識し、CARシグナルを誘導し、T細胞を活性化するためには、その抗原結合親和性が適度であることが必要です。T細胞を活性化し、腫瘍細胞を死滅させるのに十分な親和性を持つ一方で、抗原発現量の少ない組織への毒性を生じたり、過剰な活性化により自己破綻して死に至ることがないよう制御することも重要です。さらに、CAR分子の標的抗原への結合を最適化するためには、エピトープの位置、標的細胞上のリガンド密度、個々のリガンド結合ドメインの親和性など、他の要因も考慮しなければなりません。
scFvの他の変数もまた、CARの機能に影響を及ぼします。例えば、VHとVLの相互作用様式や相補性決定領域(CDR)の相対的な位置は、標的エピトープに対する CAR の親和性や特異性に影響を与えることがあります。また、標的エピトープの構造、空間的利用可能性、機能なども、CARの設計において考慮されるべき要素です。
最後に、免疫原性も無視できない要素です。ハイブリドーマ法で作製されたマウスモノクローナル抗体(mAb)は強い免疫原性を有しており、ヒトの免疫系では抗原とみなされ、免疫系を介した拒絶反応を引き起こし、重症免疫疾患の原因となる可能性すらあります。したがって、scFvのヒト化は、CAR T細胞の安全性と治療能力を向上させるのに役立つと考えられます。
要約すると、scFvの親和性、特異性、標的エピトープ、および免疫原性は、CARの設計において極めて重要な考慮事項となっています。
ヒンジ領域
ヒンジ領域は、膜貫通ドメインから結合ユニットを伸ばした細胞外領域と定義されています。ヒンジは立体障害を克服するための柔軟性を提供する機能を持ち、抗原結合ドメインが標的エピトープにアクセスするための長さに寄与しています。ヒンジ領域の長さや組成の違いは、CARの発現や柔軟性に影響し、最終的にはCARのシグナル伝達やエピトープ認識などの機能に影響を与えます。したがって、最適なヒンジ領域の構造は、特定の抗原結合ドメインごとに調整する必要があります。
膜貫通ドメイン
膜貫通ドメインは、CARの細胞外ドメインと細胞内ドメインをつなぎ、リガンド認識シグナルを細胞内へ伝達する役割を担っています。膜貫通ドメインは、細胞外スペーサーや細胞内シグナル伝達ドメインの要求に応じて変化するため、CARを設計する際にはこれらの要素を考慮する必要があります。
細胞内ドメイン
共刺激ドメイン
CARの共刺激ドメインは、T細胞に第二の活性化シグナルを提供します。最も一般的な共刺激ドメインは、CD28と4-1BBです。CD28の共刺激因子は、より強い急性応答を誘導するが持続性は低く、一方、4-1BB因子は、活性化は低いが持続性は長いとされています。
シグナル伝達ドメイン
T細胞受容体(TCR)は、細胞内でCD3二量体と密接に結合しており、CD3二量体は免疫受容体チロシンベース活性化モチーフ(ITAM)を持っています。ITAMは、リンパ球特異的タンパク質チロシンキナーゼ(LCK)によりリン酸化された後、T細胞活性化シグナルを開始します。長年、CD3ζ鎖は標準的なCARのシグナル伝達ドメインとして使用されており、ITAMの数や位置といった要素もCAR設計のための情報を提供しています。
5世代にわたるCAR分子
細胞内ドメインの設計の違い、導入されるサイトカインやリガンドの違いにより、carは現在5つの世代に分かれて進化を遂げています(図2)。
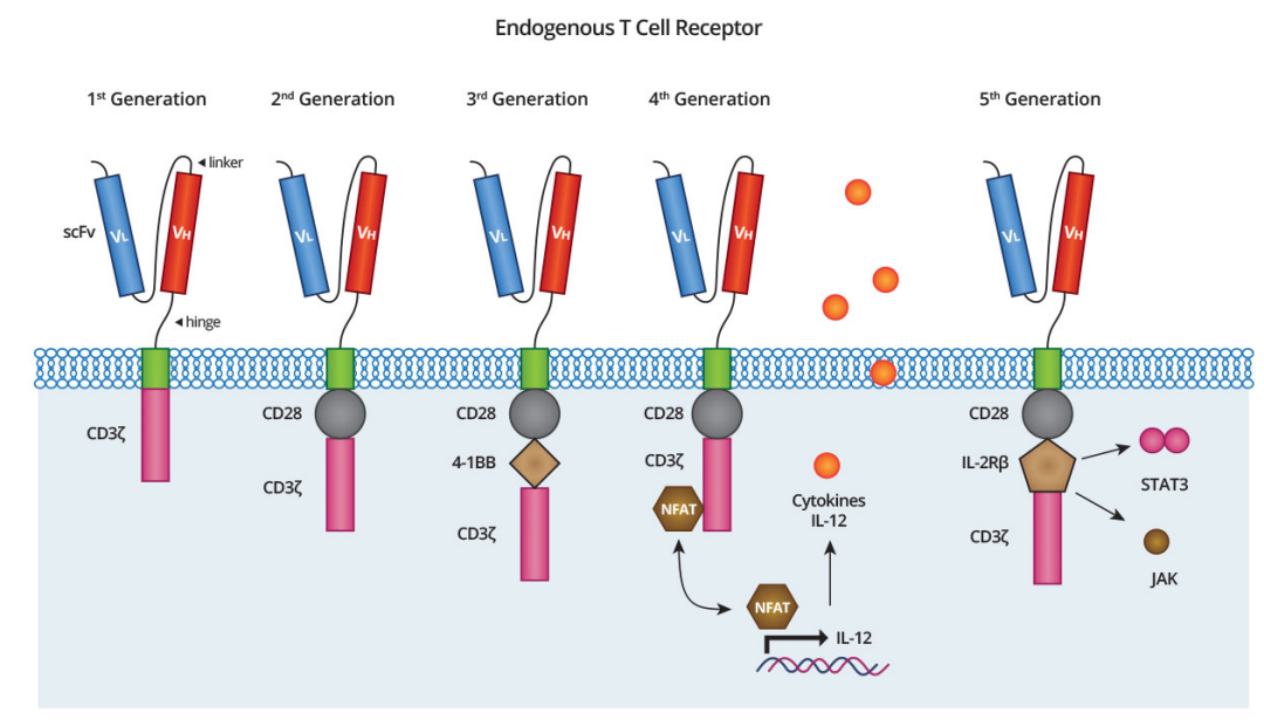
図2. CARにおける設計の3世代(第1世代、第2世代、第3世代)[1,2]
第一世代CAR
1980年代後半、Zelig Eshharら[3]は、抗体scFvとCD3ζを直接融合して一つのタンパク質とし、この融合タンパク質を発現するT細胞が、in vitroでシグナル伝達、インターロイキン分泌、特異抗原発現リンパ腫細胞の殺傷を行うことを証明しました。こうして、第一世代のCAR T細胞が誕生したのです。しかし、第一世代のCAR T細胞は、共刺激ドメインを持たないため、シグナル伝達効率が低く、生体内での増殖能が弱いことや生存期間が短いなど大きな制約があり、結局、臨床応用で期待される効果は得られませんでした。
第二世代CAR
科学者たちは、第一世代のCAR T細胞をベースに、共刺激ドメイン(CD28または4-1BB)を導入し、T細胞の活性化シグナルへの応答能力を高め、臨床応用において驚くべき治療効果を示せるようになりました。これまで発売されたCAR T細胞治療薬は、KymriahやYescartaといった第2世代の製品ばかりです。
第三世代CAR
科学者たちは、第2世代をベースに2つの共刺激ドメイン(CD28と4-1BB)を導入し、より優れたシグナル伝達効果を期待して、第3世代のCAR T細胞を作製しました。しかし、これは単純な足し算の話でありません。複数の共刺激因子を加えると、CAR Tの細胞内ドメインの長さが変化し、シグナル伝達が弱くなったり、阻害されたりする可能性があります。そのため、このアプローチの臨床的な利点については、まだ議論の余地が残されています。
第4世代CAR
CAR T細胞の機能を高めるため、科学者たちは第4世代CAR T細胞に細胞内ドメインを導入し、炎症性サイトカインであるIL-12などの低分子物質を共発現させることで、より高い治療効果を得ようとしました。細胞内ドメインは、サイトカインによるシグナル伝達を誘発したり、CAR T細胞の機能に影響を与えるシグナル伝達経路を遮断することが可能です。
第五世代CAR
第5世代CAR T細胞は、ユニバーサルCAR T(UCART)とも呼ばれ、健康な志願者から得たT細胞をノックアウトし、CAR遺伝子を導入したものです。最大の特徴は、患者からT細胞を入手することなく、バンクから直接供給できるため、時間と治療費を大幅に節約できることです。
結論
CARの各モジュールは、独立して、また相乗的にCAR T細胞の機能に影響を及ぼします。一般的に、scFvと共刺激分子の修飾がCARの設計と最適化の入口であると考えられています。また、上記の5世代のCAR以外にも、抗原損失を標的とした2価のタンデムCAR、健常組織を特異的に認識する抑制型CAR、自殺遺伝子を持つCARなど、目的別に設計された新規タイプが存在します。しかし、ヒンジ領域や膜貫通ドメインが、CARを用いた抗腫瘍機能の向上に欠かせない要素であり、CAR設計における重要な構成要素になる可能性があることも示されています。CAR設計には複数の構成要素が含まれるため、最適化の際にその効果を検証することは困難です。したがって、次世代CAR T細胞の設計の方向性を指し示すためには、体系的な評価と包括的な検討を行う必要があります。
参考文献:
[1] Fox M (July 12, 2017). "New Gene Therapy for Cancer Offers Hope to Those With No Options Left". NBC News.
[2] Mchayleh, W.; Bedi, P.; Sehgal, R.; Solh, M. Chimeric Antigen Receptor T-Cells: The Future Is Now. J. Clin. Med. 2019, 8, 207. https://doi.org/10.3390/jcm802020
[3] Parry Hannah E., Cross Ryan S., Jenkins Misty R.(2019). The Evolving Protein Engineering in the Design of Chimeric Antigen Receptor T Cells. Int J Mol Sci, 21(1), undefined. doi:10.3390/ijms21010204
[4] Eshhar, Z., Waks, T., Gross, G. and Schindler, D. G., Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc Natl Acad Sci USA 1993. 90: 720–724.
