-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
JAK1は、細胞内に存在する重要なタンパク質であり、細胞間のシグナル伝達を支え、免疫系を制御する役割を担っています。JAK1の活性を制御することは、がんや関節リウマチなどの炎症性疾患の治療において重要とされています。現在、米国FDAは複数のJAK1阻害剤をアトピー性皮膚炎の治療目的で承認していますが、これまでに開発されたJAK1阻害剤の多くが喘息への効果を示さず、臨床試験で失敗に終わっています。これは、JAKシグナル伝達が器官や組織によって異なる特異的な作用を持つことを示唆しています。したがって、JAK経路の臓器・組織特異性の理解が不可欠となります。
II型免疫応答に関与する細胞は、主に下流のJAK1シグナル経路に依存してアレルギー性炎症を誘導します。しかし、現時点では、JAK阻害が上皮細胞や線維芽細胞といった基底細胞内でどのように作用するかについては、十分に解明されていません。JAK1シグナルが特定の細胞や組織でどのように機能しているのかを深く理解することは、喘息などのアレルギー疾患に対するより的確な治療戦略の構築につながります。
最近、アメリカのIcahn School of Medicine at Mount Sinaiの研究チームは、マウスモデルを用いて、JAK1が感覚神経細胞において神経伝達や神経炎症を制御する未知の役割を果たしていることを明らかにしました。この研究成果は、『Cell』誌に掲載されており、JAK阻害療法のさらなる最適化に向けた新たな知見を提供するものであり、将来的な個別化医療の強化に寄与すると期待されています。
研究材料と方法
本研究では、研究チームが複数のマウスモデルを使用しました。C57BL/6系の野生型マウスや、適応免疫リンパ球を欠損したRag1⁻/⁻マウスなどが含まれます。その中でも、JAK1 GoFマウスおよびJak1STOPflox–JAK1 GoFマウスは、Cyagenによって構築されたものです。
研究者らは、Alternaria alternata(アルテルナリア属真菌)を鼻腔内に投与することでアレルギー性肺炎モデルを誘導し、組織病理学的手法を用いて肺組織の病理変化を評価しました。また、迷走神経ニューロンにおける各種神経ペプチドの発現を解析し、それらがJAK1シグナルによりどのように制御されるかを明らかにしました。
技術的アプローチ
1.JAK1 GoFマウスを構築
マウスのJak1遺伝子を、ヒト由来のJAK1 GoF変異体で置換します。
2.気道アレルゲンチャレンジ実験を実施
JAK1 GoFにより、アレルゲン誘導性の肺炎症が抑制されることを確認します。
3.一連の実験により検証
迷走感覚神経ニューロンにおけるJak1の発現が、肺の免疫恒常性維持に不可欠であることを明らかにします。
4.JAK1は神経ペプチドCGRPβの発現を制御
CGRPβはILC2の機能とアレルギー性肺炎症を抑制する作用を持ちます。
5.ヒトJAK1 GoFを感覚神経に導入
感覚神経特異的にヒトJAK1 GoFを発現させることで、マウスのアレルギー性肺炎症が抑制されることを実証します。
研究結果
1.JAK1 GoF変異は肺に自発的なアレルギー性炎症を引き起こさない
2017年、The University of British ColumbiaのStuart Turvey教授(本研究の共著者)は、生殖系列にJAK1のGain-of-Function(GoF)変異を有する患者を初めて報告しました。これらの患者は、湿疹、喘息、重度の好酸球増多症など、さまざまなアレルギー疾患を呈していました。研究チームは、2名の患者の臨床症状を詳細に分析し、湿疹の発症が喘息よりも明らかに早期であり、症状の重症度も高いことを明らかにしました。これは、JAK1の活性化が組織ごとに異なる影響を及ぼすことを示唆しています。
この組織特異的な影響を解明するため、研究者らはCyagen社に委託し、マウスのJak1遺伝子をヒトJAK1 GoF変異に置換したJAK1 GoFマウス系統を作製しました。結果として、このマウスは出生直後から湿疹様の皮膚症状を呈しましたが、対照マウスにはそのような症状は見られませんでした。興味深いことに、皮膚とは対照的に、JAK1 GoFマウスの肺には炎症性変化が認められませんでした。このことから、研究者らは「肺はJAK1依存性炎症に対して自然の抵抗力を持っているのではないか」という仮説を立てました。
2.組織基質におけるJAK1 GoFはアレルゲン誘導性肺炎症を抑制する
この仮説を検証するため、研究チームは気道アレルゲンチャレンジ実験を実施し、JAK1の活性化が肺における炎症応答を増強するかを評価しました。喘息関連の真菌性アレルゲンであるAlternaria alternata(アルテルナリア)を用い、JAK1 GoFマウスと対照マウスに鼻腔投与を行いました。
組織病理学的解析により、JAK1 GoFマウスではアレルゲン刺激後に気道の再構築、炎症細胞浸潤、杯細胞の増生、粘液分泌の亢進が観察され、対照群よりもアレルギー性病理変化が顕著であることが確認されました。これらの結果から、JAK1の全身的な活性化自体は肺に自発的炎症を引き起こさないものの、外的アレルゲンの刺激により炎症が誘導されやすくなることが示されました。
肺が恒常状態ではJAK1活性に対して耐性を持つことを踏まえ、研究者らは肺組織の基質細胞におけるJAK1活性化が、この耐性に関与しているのではないかと考えました。そこで、野生型マウス由来の骨髄を野生型(WT)およびJAK1 GoFマウスに移植し、骨髄キメラマウス(WT→WTおよびWT→JAK1 GoF)を作製しました(図1)。
その結果、WT→JAK1 GoFマウスでは、アレルゲン刺激に対する肺の病理反応が顕著に低下し、II型自然リンパ球(ILC2)や好酸球の頻度も有意に減少していることが確認されました。さらに、RNAシーケンシングとKEGG経路解析により、WT→JAK1 GoFマウスでは喘息および炎症関連経路の発現が大幅に抑制されていることが明らかとなりました。
これらの予想外の結果は、JAK1 GoFの基質発現が肺炎症に対する耐性を付与していることを強く示唆しています。
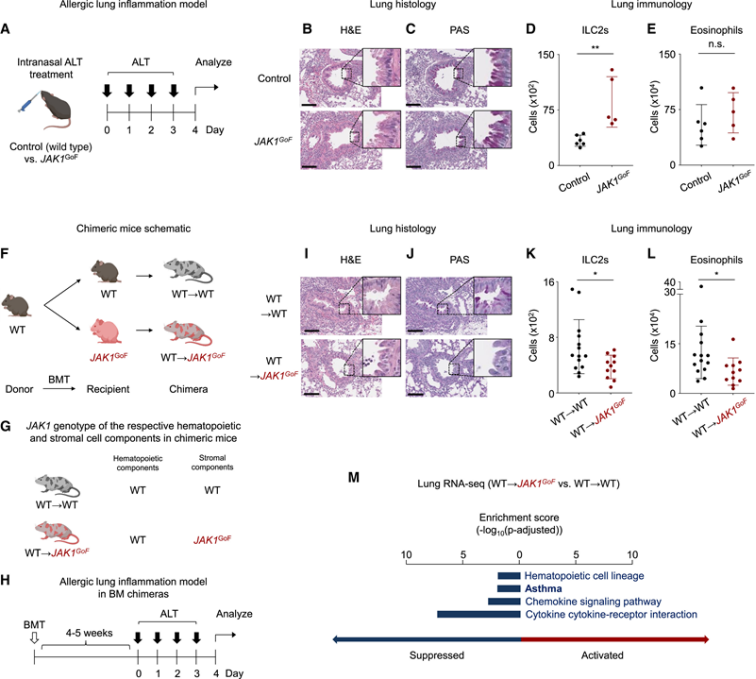
図1. JAK1 GoFの基質発現はアレルギー性肺炎症に対して保護的に作用する
3.感覚神経ニューロンにおけるJAK1は肺炎症および神経ペプチドのレベルを調節する
近年の報告により、感覚神経ニューロンが肺の炎症反応を抑制する役割を持つことが示唆されています。これに基づき、研究者らは、JAK1シグナル伝達を介して感覚神経が肺炎症を調節する経路が存在すると仮定しました。
彼らはTRPV1アゴニストであるレシニフェラトキシン(resiniferatoxin)を用いてTRPV1を発現する神経を標的とし、神経支配を除去する実験を行いました。皮下注射により処理されたマウスは痛覚を喪失し、神経除去が成功したことが確認されました。驚くべきことに、神経支配の除去後、マウスにおける気管支周囲および血管周囲の炎症細胞浸潤、杯細胞の増殖、粘液分泌が著しく増加し、II型自然リンパ球(ILC2)および好酸球の頻度も上昇しました。
さらに解析を進めた結果、迷走感覚神経がアレルギー性肺炎症の抑制において重要な役割を果たすことが明らかとなりました。
研究チームは、迷走神経節(vagal ganglion, VG)のNav1.8陽性感覚神経ニューロンの大部分がJak1を発現していることを、単一細胞RNAシークエンスデータから確認しました。これにより、迷走感覚神経におけるJak1の発現が肺の免疫恒常性に必須であるという仮説を立てました。
この仮説を検証するために、研究者らは神経特異的にJak1を欠損させた条件付きノックアウトマウス(Jak1^Δneuron)を使用しました。アレルゲン暴露後、Jak1^Δneuronマウスではすべての炎症指標が著しく増加し、Nav1.8陽性感覚神経におけるJAK1シグナルが肺におけるアレルギー性炎症を抑制することが示されました(図2)。また、パパイン(papain)によるプロテアーゼ誘導型アレルギーモデルにおいても同様の結果が確認されました。
近年、感覚神経が神経ペプチドを放出して、粘膜バリア組織の炎症反応を調節することが多数報告されています。これに基づき、JAK1が神経ペプチドの発現を制御することで、神経炎症や組織炎症の制御に関与している可能性が示唆されます。
複数の神経炎症関連ペプチドをスクリーニングした結果、迷走神経節において、JAK1はCalcbを含む複数の神経ペプチドの発現を調節していることが判明しました(図2)。CalcbはCGRPβ(カルシトニン遺伝子関連ペプチドβ)をコードしており、JAK1による細胞プログラム制御がSTATタンパク質のリン酸化に依存することから、CALCBがSTAT6の転写標的であるとするバイオインフォマティクス解析の結果と一致しています。
以上より、CGRPβはJAK1によって制御される主要な免疫調節性神経ペプチドの1つである可能性が高いと考えられます。
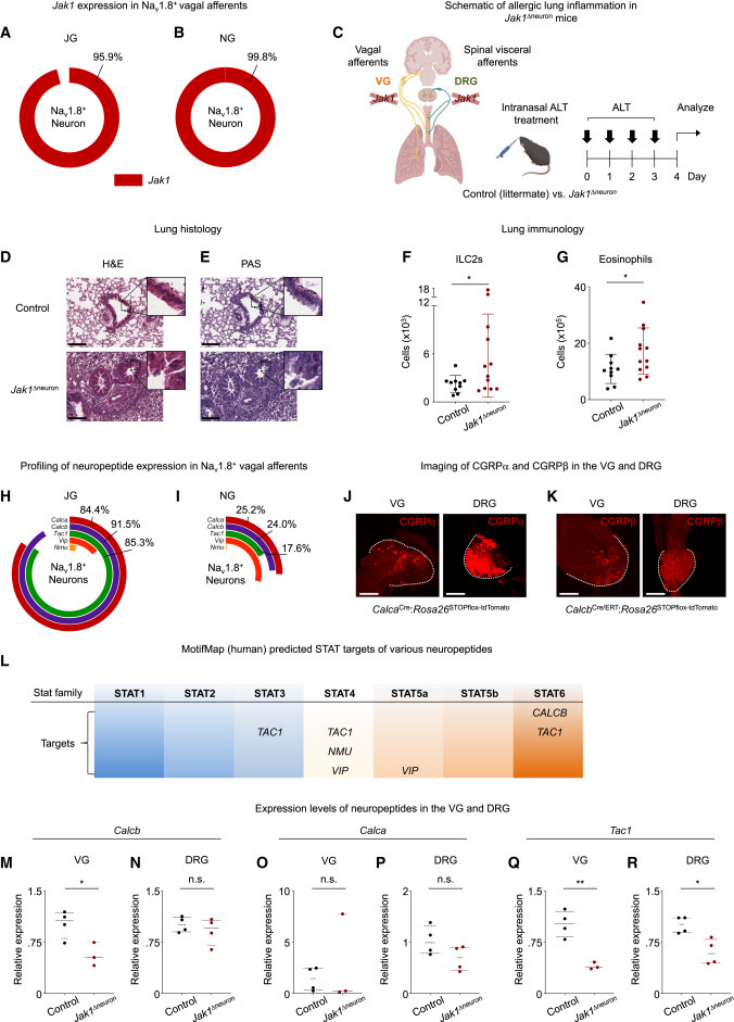
図2. 感覚神経ニューロンにおけるJak1の欠損はアレルギー性肺炎症を増悪させ、神経ペプチドの発現レベルを変化させる
4.CGRPβはILC2の機能およびアレルギー性肺炎症を抑制する
ILC2(Group 2 innate lymphoid cells)はアレルギー性肺炎症の主要なドライバーとして知られていますが、CGRPβ(カルシトニン遺伝子関連ペプチドβ)の役割については未解明な点が多く残されています。
研究者らは、まずin vitro(培養下)において、CGRPβがILC2によるIL-5およびIL-13の産生を有意に抑制することを発見しました。次に、適応免疫を欠損するRag1⁻/⁻マウスを用い、CGRPβがin vivoでILC2反応および肺炎症を抑制できるかを評価しました。
アレルゲンによる鼻腔刺激後、Rag1⁻/⁻マウスではILC2と好酸球の著しい増加が見られましたが、CGRPβを投与したマウスではこれらの免疫細胞応答および肺組織の炎症が有意に低下しました。さらに、CGRPβ受容体拮抗剤を投与した場合には、肺炎症がむしろ悪化しました。
これらの結果から、CGRPβはILC2の活性およびアレルギー性肺炎症を抑制する重要な免疫調節因子であることが示唆されました。
5.ヒトJAK1 GoFを感覚神経に導入することでアレルギー性肺炎症を抑制可能
研究者らは最終的に、ヒトJAK1 GoF変異体を肺の感覚神経に特異的に導入することで、アレルギー性炎症を抑制できるかを検証しました。
具体的には、ヒトJAK1 GoF変異をコードする逆位型アデノ随伴ウイルス(AAV)ベクターをマウス体内に投与し、その後アレルゲンによる気道刺激を行いました。その結果、迷走感覚神経におけるAAV感染が確認され、肺炎症が明確に抑制されました。
さらに、同じヒトJAK1 GoF変異をマウスの感覚神経に遺伝子導入した場合でも、同様に肺のアレルギー性炎症が抑制されることが実証されました。
これらの知見は、JAK1が感覚神経におけるCGRPβの発現を調節し、肺の免疫恒常性を維持する上で重要な役割を果たしていることを強く支持しています。
研究結論
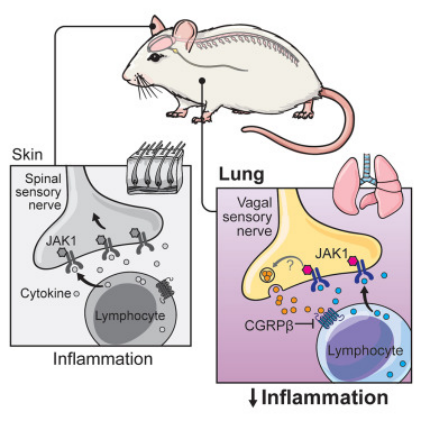
図3 研究の示意図
本研究により、リンパ球におけるJAK1の活性化が広範な炎症促進作用を有する一方で、感覚神経系におけるJAK1の活性化は、これまで知られていなかった免疫調節機能を持つことが明らかになりました。
この発見は、JAK1阻害剤が湿疹の治療には非常に有効である一方、喘息治療では十分な効果を示さなかった理由の一端を説明するものと考えられます。
また論文では、さまざまな神経ペプチドが皮膚、肺、腸といったバリア組織における炎症をどのように調節しているかを解明することが、神経免疫学の新たな研究領域として注目されていることにも言及しています。
将来的には、感覚神経を介した炎症制御という観点から、炎症性疾患のみならず、感染症、代謝疾患、さらには悪性腫瘍に対する新たな治療戦略が開発される可能性があります。
論文情報
Tamari M, Del Bel KL, Ver Heul AM, et al. Sensory neurons promote immune homeostasis in the lung. Cell. 2024 Jan 4;187(1):44-61.e17.
