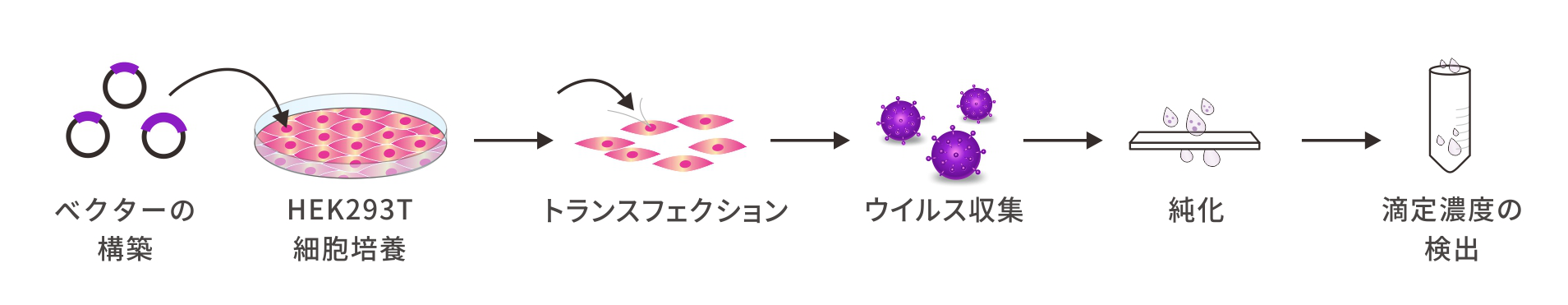
ウイルスベクターの設計と開発
遺伝子導入ツールの選択は遺伝子治療における重要な部分です。薬物が最終的に人体内での効果を表れるには、安定して効率的な導入システムに大きく依存します。現在、遺伝子治療によく使用されているベクターには、ウイルスベクターと非ウイルスベクターがあり、宿主範囲が広く、作用時間が長いため、ウイルスベクターは遺伝子治療研究でますます広く使用され、コーディング遺伝子、非コーディング遺伝子の過剰発現、干渉、ノックアウト、および内因性活性化などの操作が行えます。アデノ随伴ウイルス(AAV)、アデノウイルス(ADV)、レンチウイルス(LV)を含む一般的に使用されるウイルスは、異なる感染特性を有します。そのうち、AAVは、優れた組織特異性、低い免疫原性、および高い安全性という利点を有し、現在、遺伝子導入および遺伝子治療で最も広く使用されているデリバリーベクターです。
|
AAVベクタータイプ |
ウイルス量 |
ウィルス濃度 |
納期 |
|
精製過剰発現AAVの少量調製 |
≥1*10^12 GC |
≥1*10^12 GC/mL |
5-6週間に短縮 |
|
精製過剰発現AAVの中量調製 |
≥5*10^12 GC |
≥1*10^13 GC/mL |
|
|
精製干渉AAVの少量調製(3+1) |
≥1*10^12 GC |
≥1*10^12 GC/mL |
|
|
精製干渉AAVの中量調製(3+1) |
≥5*10^12 GC |
≥1*10^13 GC/mL |
|
|
精製ノックアウトAAVの少量調製 |
≥1*10^12 GC |
≥1*10^12 GC/mL |
|
|
精製ノックアウトAAVの中量調製 |
≥5*10^12 GC |
≥1*10^13 GC/mL |
|
血清型 |
標的組織 |
血清型 |
標的組織 |
|
AAV1 |
筋肉、心臓、神経、骨格筋 |
AAV rh10 |
肝臓、血液、心臓、体外細胞 |
|
AAV2 |
筋肉、肝臓、脳組織、目、神経 |
AAV2-retro |
神経細胞(逆行非トランスシナプス) |
|
AAV5 |
肺、目、神経、膵臓 |
AAV-DJ |
網膜、肺、腎臓、体外細胞 |
|
AAV6 |
肺、心臓 |
AAV-DJ-8 |
肝臓、目、中枢神経 |
|
AAV7 |
筋肉、肝臓 |
AAV9-CNS |
中枢神経系 |
|
AAV8 |
筋肉、肝臓、神経、目 |
AAV9-PNS |
外周神経系 |
|
AAV9 |
心臓、筋肉、肺、肝臓、神経 |
より多くの血清型 |
お問い合わせください |
AAVウイルスパッケージングサービスの利点:
- 納期が短い:ウイルスには現品の納期は2週間、カスタマイズのプロジェクトの納期は5週間に短縮します。
- 品質の信頼性が高い:ウィルス濃度≥1*10^12 GC/mL,純度≥95%、エンドトキシン<10 EU/mLを確保し、高い感染効率を保証します。
- 専門サポート:ベクター設計、ウィルスパッケージングと使用、体内注射から、表現型分析までの専門技術指導を提供できます。
- 経験豊富:十数年のウィルスパッケージング経験を持ち、ウイルスデータベースを拡大しつつあり、顧客用の引用文献を複数発表しました。
- AI人工知能による強化:強力な人工知能および生物学的情報チームがAAVベクターの開発、最適化および改造サービスを提供します。
|
AAVウイルスベクタータイプ |
ウィルス濃度 |
納期 |
|
|
レンチウイルス(LV) |
標準仕様 |
≥1*10^8 TU/mL |
5-8週間 |
|
精製 |
≥1*10^9 TU/mL |
||
|
アデノウイルス(ADV) |
標準仕様 |
≥1*10^10 PFU/mL |
7-10週間 |
|
精製 |
≥1*10^12 PFU/mL |
||
Q1:AAV、LV、ADV 3つのツールウイルスの違いは、何でしょうか?
|
項目 |
AAV |
ADV |
LV |
|
粒子径 |
20-30nm |
90-100nm |
80-100nm |
|
ゲノム |
4.7kb一本鎖DNAまたは2.4kbの二本鎖DNA |
36kb二本鎖DNA |
9.3kb二本鎖RNA |
|
ベクターサイズ |
≤4.5kb |
8.3kb |
≤6kb |
|
発現量 |
中高レベル段階の発現 |
高レベルの瞬時発現 |
中レベルの安定発現 |
|
発現の適時性 |
7‐14日、発現開始、 |
1‐2日、発現開始、 |
2‐4日、発現開始、 |
|
通常は、6ヶ月から24ヶ月 |
継続≤(2-4)週間 |
継続≥6ケ月 |
|
|
体内の拡散能力 |
強い |
強い |
普通 |
|
免疫原性 |
極めて低い |
強い |
中低 |
|
統合方法 |
少量ターゲット統合 |
不統合 |
高頻度ランダム統合 |
|
特徴 |
産出量が高くて、構成がシンプルで、安全性が高いです |
産出量が高くて、精製しやすいです |
産出量が低くて、発現が安定します |
|
適用 |
動物実験の第一選択 |
細胞/動物の大きな遺伝子の過剰発現 |
細胞実験の第一選択 |
Q2:なぜAAVは遺伝子治療の分野で現在最も人気のあるベクターなのですか。
これは、AAVには次の利点があるためです。
1. 広い宿主範囲:分裂細胞と非分裂細胞があります。
2.高い安全性:病原性AAVが未発見です。ITRとrep/capは、独立したプラスミド発現;です。
3.低い免疫原性:動物または人体に対する免疫応答は小さく、複種のウイルスベクターのうち、比較的小さいです。
Q3:AAVが動物体内での発現を実現するためには、どの注意すべきキーポイントがありますか。
1. 血清型の選択。AAVの血清型は、主にAAVカプシドタンパク質の構造に決め、異なるカプシドタンパク質は、異なる細胞表面受容体を特定しますので、血清型の選択は、AAVの感染効率、組織親和性、発現開始時間に影響を与えます。
2. プロモーターの選択とは、広域スペクトルプロモーターそれとも特異性プロモーターを選択するということです。血清型の組織特異性に比べ、特異性プロモーターは細胞特異性が実現化可能のため、特異性要求が高い研究に対して、特定の細胞特異性発現のプロモーターを選択しても良いです。
3. 注射方法。局所注射可能な組織および臓器に対して、標的臓器の局所多点注射はより優れた特異性および発現効果が達成できます。
4. ウィルス量および濃度。異なる標的臓器や組織に用いられる異なるAAV血清型(拡散能力がことなる)によって、推奨するAAV注射量が異なります。組織に送達されるウイルス粒子の量は感染効果に大きく影響します。但し、AAVの使用量は多いほど良いのではなく、ウイルス量が多すぎるとオーバーフローの可能性があります。我々の経験では、ウイルスが多すぎると発現が低減する可能性があります。具体的な組織のウイルス使用状況を知りたい場合は、お問い合わせください。
Q4:マウスへのAAV注射にはどのくらいのウイルス量で十分ですか。
研究者様がウィルスパッケージングで遠回りするのを避けるため、サイヤジェンは、レンチウイルス(LV)およびアデノ随伴ウイルス(AAV)パッケージングについてよくある質問を集めた「ウイルスパッケージングの質問・回答百科」を作成しました。随時確認して使用しますので、実験で模索する時間を大幅に節約できます。「細胞技術サービス」を選択してダウンロードするには、ここをクリックしてください。
