-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
常染色体優性遺伝性多発性嚢胞腎(ADPKD)は、生命を脅かす最も一般的な遺伝性疾患の一つです。ADPKDでは、両側の腎臓に液体を含んだ嚢胞が発生し、持続的に増殖し、最終的には腎不全に至ります。一般的な遺伝性疾患のいくつかとは異なり、ADPKDは世代を超えた遺伝には属さないため、家族内の多くの人が罹患ケースが多く見られます。PKD1またはPKD2遺伝子のいずれかの変異がADPKDの大部分を占め、PKD1の変異が最も多く、ADPKDに罹患した患者さんの約85%を占めています。
以下では、ADPKDとその原因遺伝子であるPKD1、そして研究に用いられているPkd1ノックアウトマウスについてご紹介します。
常染色体優性多発性襄胞腎(ADPKD)とは?
常染色体優性 多発性嚢胞腎(ADPKD)は、有病率1/400~1/1,000の一般的な遺伝性腎疾患であり、末期腎不全(ESRD)の4番目の原因となっています。主な臨床的特徴は、高血圧、血尿、尿路感染、腎結石、石灰化などの臨床症状を伴う腎嚢胞の進行性肥大です。
ADPKDは、PKD1および/またはPKD2遺伝子の変異によって引き起こされる、常染色体優性遺伝の単一遺伝子疾患です。図1に示すように、PKD1またはPKD2のヘテロ接合体変異を有する患者は、50%の確率で子孫に本疾患を発症すると言われています。
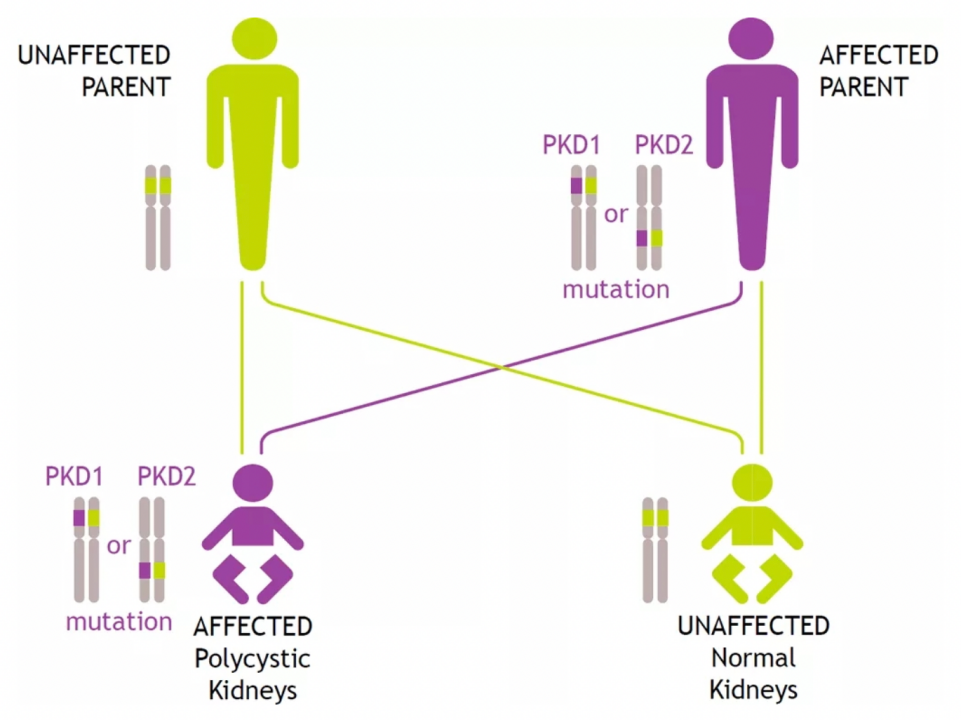
図1. ADPKDの遺伝的家系図[1]
PKD1およびPKD2の変異は、それぞれADPKD症例の85%および15%を占めています。そして、PKD1変異を有するADPKD患者は、PKD2変異を有する患者よりも重篤な疾患が発症しやすいとされています。これまでに、ヒト遺伝子変異データベース(HGMD)には1,177件のPKD1変異と211件のPKD2変異が、 ADPKD変異データベース(PKDB)(PKDB)には2,323件のPKD1変異と278件のPKD2変異が記録されています。図2は、PKD1遺伝子に見つかった確実な病原性変異と可能性が高い病原性変異の分布を示しています。PKD1の病原性変異は、ミスセンス変異、ナンセンス変異、挿入・欠失、スプライシング変異、大規模なゲノム再構成など、その種類は様々です。そして、これらの変異は遺伝子の様々な位置に存在し、変異のホットスポットは存在しないとされています。
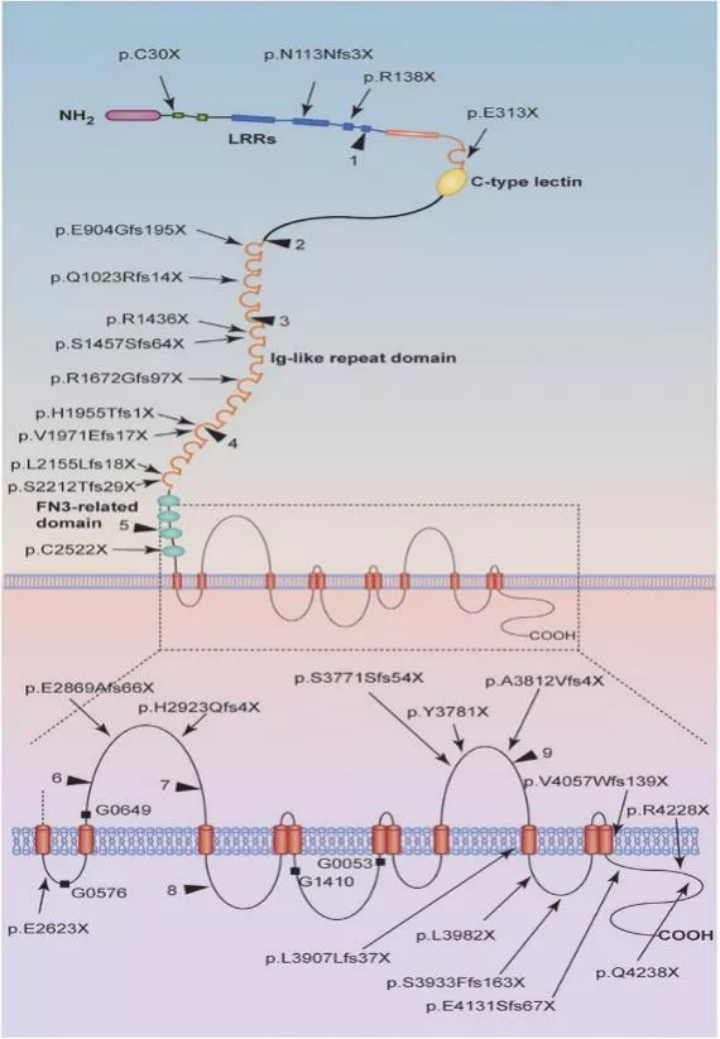
図1. PKD1における変異模式図[1]
*ナンセンス変異とフレームシフト変異は矢印表示。
*挿入、欠失、スプライシング変異は正方形表示(G0576:c.8017-2-1delAG; G0649:c.8157-8159delCAC; G1410:c.10220 + 2T > C; G0053:c.10617 + 1delG).
*病原性の高い変異は三角表示。
PKD1遺伝子とは?
PKD1遺伝子(Polycystin 1, Transient Receptor Potential Channel Interacting)は、ヒト染色体16p13に位置し、全長約47kb、総エクソン数46で、4302アミノ酸残基からなる膜貫通型糖タンパク質-ポリシスチン1(PC1)をコードしています。
PKD1がコードするPC1タンパク質は、外部からの刺激を感知する受容体として働き、細胞質環状アデノシン一リン酸(cAMP)濃度と下流のシグナル伝達を調節し、細胞-細胞および細胞-マトリックスの相互作用を媒介することが可能です。PKD1は腎尿細管の発生に重要な役割を果たしており、この遺伝子の変異はADPKDと密接に関連しています。
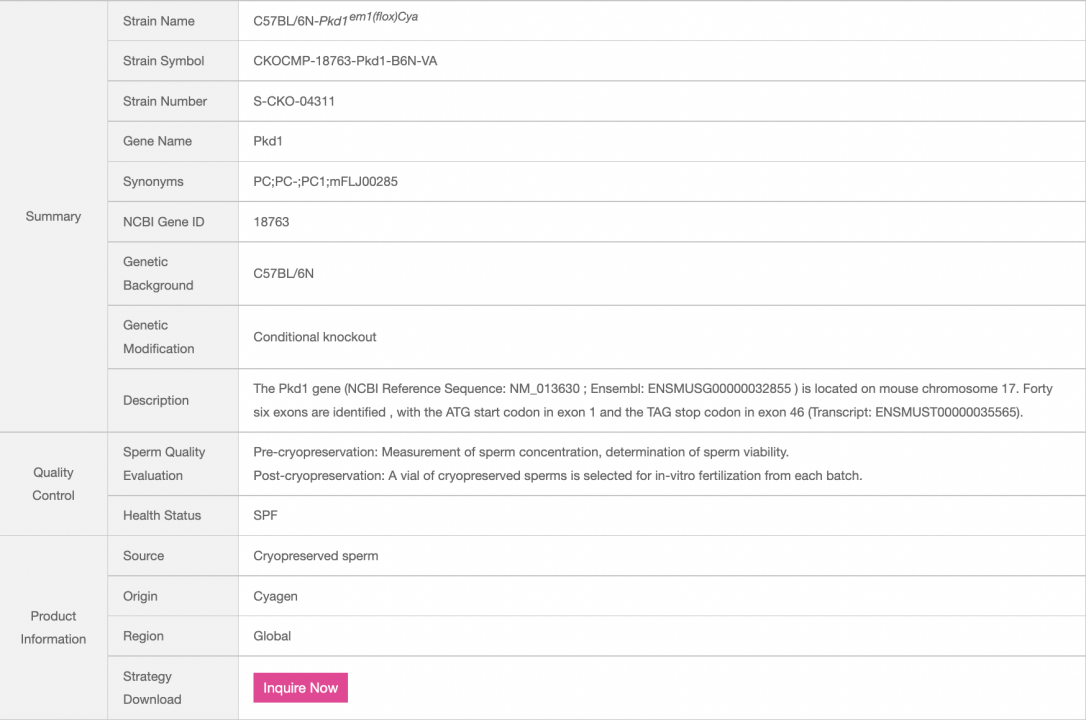
表1. サイヤジェン Pkd1コンディショナルノックアウトマウスに関する基本情報
研究ツール:Pkd1ノックアウトマウス
Pkd1ホモノックアウトマウスは通常、幼児期に死亡し、腎臓と膵臓に重度のシストを発症します。一方、ヘテロ接合型ノックアウトマウスでは、発生後期に肝臓にわずかなシストを発症するのみです。[2]
Pionteらは、生後13日目のマウスでPkd1をノックアウトすると、3週間以内に重度の腎臓シストを発症することを示しました。対して、出生後期に遺伝子ノックアウトを行うと、5ヶ月後までシストを発症しませんでした。この結果より、Pkd1不活性化の病理学的影響は、臓器発生に依存することが示唆されました。[3]
Cabritaらは、Pkd1の欠損がマウス腎臓におけるTMEM16Aと嚢胞性線維症膜貫通コンダクタンスレギュレーター(CFTR)の発現と塩素分泌を増加させ、TMEM16AとCFTRが分泌する経上皮性塩素がシストの拡大を引き起こすことを示しました。特異的阻害剤Ani9によりin vivoでのTMEM16Aを阻害すると、シスト拡大や異常なシスト細胞増殖を大きく抑制することができます。この研究結果は、ADPKDの治療に新たなアイデアを提供するとともに、TMEM16AがADPKDの嚢胞の成長を抑制するための重要な治療標的であることを裏付けました。[4]
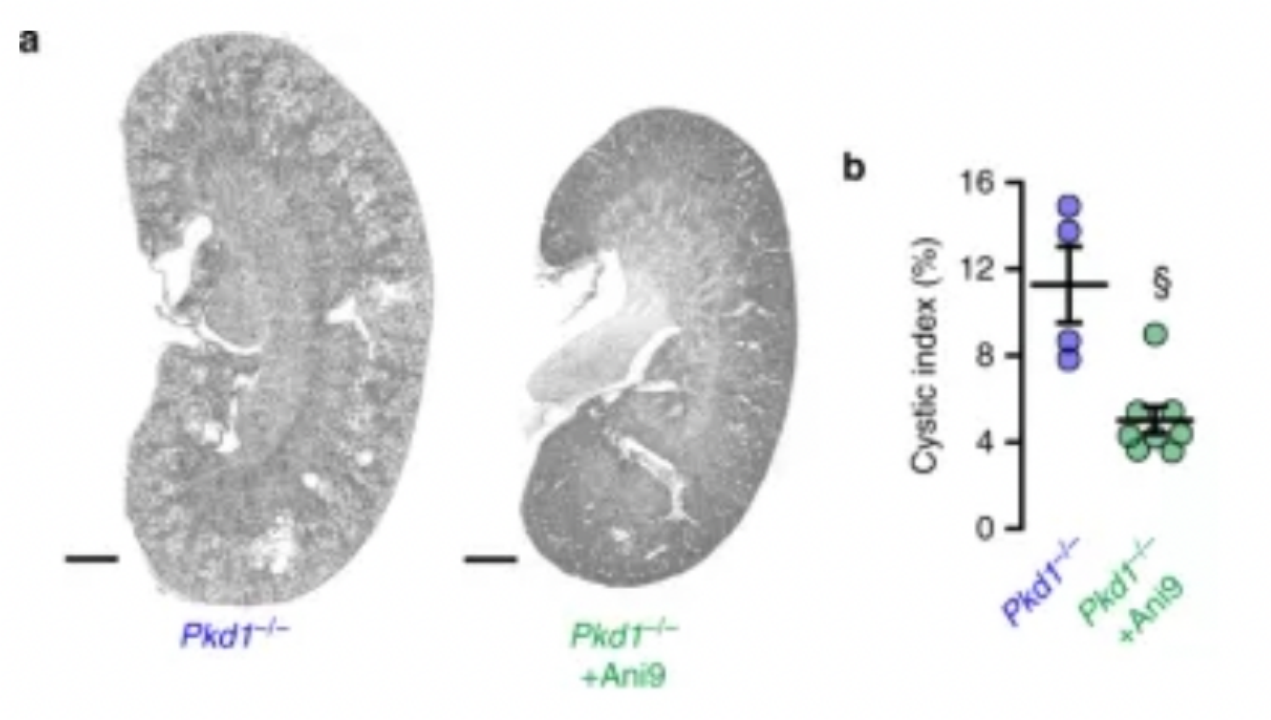
図2. TMEM16A特異的阻害剤Ani9による、in vivoでの腎嚢胞成長抑制[4]
- マウスの腎臓画像、スケールバー:1000 µm。
- Pkd1-/-マウスとAni9投与Pkd1-/-マウスのシスト化指数(%)。
ADPKDの診断と治療
ADPKDの診断は、主に超音波検査、CT、MRIなどの画像検査に依存しています。診断に重要な因子としては、家族歴、患者の年齢、両側腎嚢胞の数などが挙げられます。画像診断の結果、結論が出ない場合は、遺伝子検査で診断を補助することができます。
ADPKDの現在の臨床治療は、疼痛、血尿、および高血圧などの合併症による症状の緩和に重点を置いています。末期腎不全(ESRD)に進行した場合は、腎移植などの腎代替療法(RRT)が必要となります。主な治療薬は、バソプレシンV2受容体拮抗薬トルバプタン、mTOR阻害薬シロリムスとエベロリムス、ソマトスタチン(SST)オクトレオチドやスタチンなどがあります[5]。
要約
PKD1はADPKDの2大原因遺伝子の1つであり、この遺伝子の変異はADPKD症例の最大85%を占めると言われています。ADPKDの原因となるPKD1の変異は、これまでに2,000件以上報告されています。これらの疾患を引き起こす変異は種類が多く、遺伝子の異なる位置に分布しており、変異のホットスポットが存在しないため、ADPKD患者の遺伝子解析の難易度を大きく高めています。現在、ADPKDの治療薬は開発されていませんが、ADPKDの合併症の症状は薬物によって緩和することが可能です。TMEM16Aを阻害すると、マウスにおける嚢胞の拡大や増殖が大幅に抑制されることが研究で示されており、ADPKDにおける重要な治療標的となっています。しかし、TMEM16Aを治療標的とするADPKD治療の有効性については、前臨床試験および臨床試験でまだ検証する必要があります。
サイヤジェン Pkd1 KOマウスによる研究加速化への支援
この研究テーマにご興味のある方は、ノックアウトカタログモデルをご覧ください。この記事で紹介したADPKD研究用のPkd1遺伝子ノックアウトマウスやコンディショナルノックアウトマウスは、弊社の3,000以上のベストセラー遺伝子に含まれており、最短(2)週間以内で納品可能です!価格マッチング保証により、お客様の研究に最も適したコストパフォーマンスの高い実験用マウスを簡単に入手できます!
他にもお探しでしょうか?他にもたくさんの遺伝子改変マウスをご用意しております。ご相談やご注文は、メール([email protected])にて承っております。
参考文献:
[1] Liu B, Chen SC, Yang YM, et al. Identification of novel PKD1 and PKD2 mutations in a Chinese population with autosomal dominant polycystic kidney disease [published correction appears in Sci Rep. 2016;6:21578]. Sci Rep. 2015;5:17468. Published 2015 Dec 3. doi:10.1038/srep17468.
[2] Harris PC, Torres VE. Polycystic kidney disease. Annu Rev Med. 2009;60:321-337. doi:10.1146/annurev.med.60.101707.125712.
[3] Piontek K, Menezes LF, Garcia-Gonzalez MA, Huso DL, Germino GG. A critical developmental switch defines the kinetics of kidney cyst formation after loss of Pkd1. Nat Med. 2007;13(12):1490-1495. doi:10.1038/nm1675.
[4] Cabrita, I., Kraus, A., Scholz, J.K. et al. Cyst growth in ADPKD is prevented by pharmacological and genetic inhibition of TMEM16A in vivo. Nat Commun 11, 4320 (2020). https://doi.org/10.1038/s41467-020-18104-5.
[5] Cong Li, Yin Wu, Peng Li, Geng Zhang, Chunlei Li. Research progress of drugs for autosomal dominant polycystic kidney disease[J]. Drugs & Clinic, 2015, 30(9): 1167-1171.
