-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
制御性T(Treg)細胞は、免疫系の過活性化と過少活性化を制御し、免疫の恒常性を維持する上で重要な役割を担っています。腫瘍微小環境(TME)において、Treg細胞は、がん細胞を主に殺すエフェクターT細胞(CD8+T細胞を含む)を抑制しています。したがって、腫瘍の微小環境におけるCD8+ T細胞とTreg細胞のバランスは、様々ながんの予後にとって重要な意味を持ちます。
免疫チェックポイント阻害療法は、がん患者さんに新たな希望をもたらしますが、この療法を受けても半数以上の患者さんが奏効しないため、奏効者を選別するバイオマーカーを定義し、より有効ながん免疫療法を開発することが必要とされています。最近の研究では、エフェクターT細胞とエフェクターTreg細胞(eTreg、活性化Treg細胞)のPD-1発現のバランスが、PD-1阻害療法の予測マーカーとして有望であることが明らかになりました。
エフェクターT細胞とTreg細胞は代謝プロファイルが異なることを踏まえ、2022年1月、国立がん研究センターの研究者がCancer Cellに「Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments」(乳酸は、解糖度の高い腫瘍微小環境における制御性T細胞のPD-1発現を促進する)と題した論文を発表し、同論文は、TMEにおけるPD-1発現エフェクターT細胞とTreg細胞のバランスがどのように形成されるかを、代謝の観点から論じています。それによれば、乳酸はTreg細胞の代謝チェックポイントとして働き、TMEにおける免疫反応を制御する可能性が示唆されました。

材料と方法
同研究では、進行性胃がん、非小細胞肺がん、悪性黒色腫の患者から腫瘍サンプルと腫瘍浸潤リンパ球(TIL)を採取しました。マウス大腸がん細胞株やヒトT細胞白血病細胞株Jurkat E6.1など、マウスやヒトの多くの細胞株でin vitro実験が行われました。また、Cyagen(サイヤジェン)が提供したSlc16a1完全ノックアウトマウスとコンディショナルノックアウトマウスを用いて、動物モデルでのin vivo試験も実施されました。
主にRNA(RNA-seq)と全エキソーム配列決定、変異解析を使い、ChIP-seqデータの処理と解析も行われました。さらに、アポトーシス解析、増殖解析、免疫組織化学(IHC)解析や、LC-MS、ウェスタンブロッティング(WB)、RT-PCRによる解析も実施されました。
研究成果
-
乳酸はeTreg細胞のPD-1発現を促進する
まず、研究チームは、TMEのTreg細胞におけるPD-1の発現に影響を与える要因について検討しました。腫瘍は主にブドウ糖を利用して解糖を促進し、生存を図っています。低グルコース・高乳酸の環境はエフェクターT細胞には適さないが、Treg細胞は大量に浸潤し、免疫抑制機能を発揮します。胃がんおよび非小細胞肺がんのサンプルを用いた解析により、高解糖度の腫瘍ではeTreg細胞のPD-1発現が上昇し、腫瘍浸潤CD8+T細胞とTreg細胞の比率およびCD8+T細胞のPD-1発現は有意に低下していることが判明されました。
次に、CD8+T細胞よりもeTreg細胞でPD-1の発現が高くなる作用機序についても検討が行われました。乳酸は腫瘍の解糖の最終産物であり、乳酸トランスポータータンパク質MCT1をコードするSlc16a1遺伝子がPD-1+ eTreg細胞に高発現していることを考慮し(図1)、彼らはMCT1に注目しました。ChIP-seqデータを解析した結果、FOXP3はeTreg細胞においてMCT1およびその相互作用タンパク質CD147の発現を促進することが発見されました。
では、乳酸はeTreg細胞のPD-1発現とどのように関係しているのでしょうか。その結果、eTreg細胞におけるPD-1発現は乳酸濃度の上昇に伴い有意に増加したが、CD8+T細胞におけるPD-1発現は逆の傾向を示すことが確認されました。同時に、乳酸はeTreg細胞の増殖を促進し、そのアポトーシスを抑制することができます。これらの結果は、低グルコース・高乳酸環境において、eTreg細胞がMCT1を介して乳酸を取り込み、それによってPD-1の発現をアップレギュレートしていることが示唆されました。
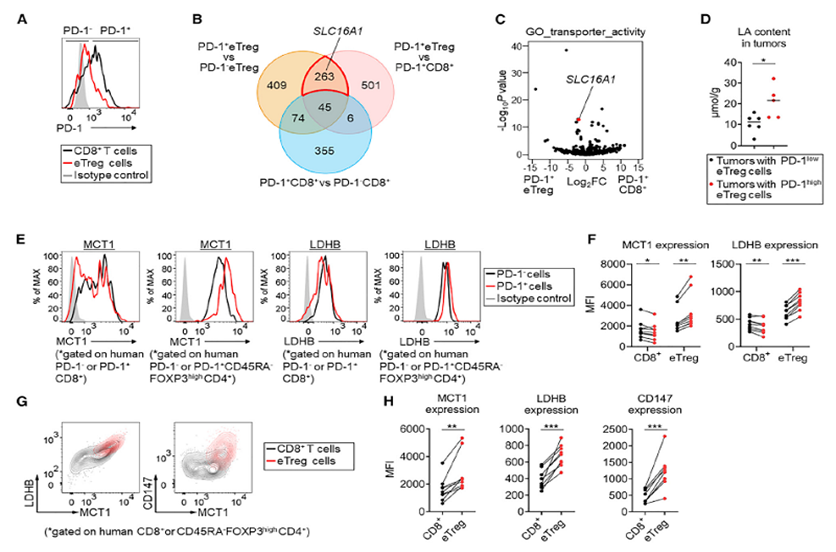
図1.乳酸はMCT1を介してeTreg細胞のPD-1発現を誘導する
-
PD-1阻害はeTreg細胞の免疫抑制活性を高める
その後の解析で、PD-1阻害はこの環境下でeTreg細胞の活性を高め、CD8+T細胞のエフェクター機能をより強く抑制することが示されました。このことは、乳酸によるPD-1高発現のeTreg細胞とPD-1阻害治療の失敗の直接的な相関を示唆するものでもありました。動物モデルの解析と合わせて、MYCの発現が解糖系活性を制御し、高乳酸状態の腫瘍微小環境を作り出すことで、T細胞集団のPD-1の発現バランスを調整していることを明らかにしました。
-
乳酸はeTreg細胞のPD-1発現を促進する
その後、in vivo実験を行ったところ、肝内腫瘍は確かに解糖を促進し、腫瘍の微小環境下にあるTreg細胞のPD-1発現を促進し、CD8+T細胞数およびPD-1発現が有意に減少することが見出されました。PD-1抗体療法は、肝内腫瘍に対して抗腫瘍効果を示さず、むしろ腫瘍内のTreg細胞を活性化させました。結論として、腫瘍の微小環境における高濃度の乳酸は、Treg細胞によるPD-1の発現を誘導し、PD-1抗体治療への抵抗性につながることが明らかにすることができませんでした。Treg細胞の乳酸代謝を阻害することで、PD-1阻害療法に対するMyc過剰発現腫瘍の抵抗性を克服することができました。
最後に、胃がん、非小細胞肺がん、悪性黒色腫などの複数のがん患者コホートにおいて、LDHAとMYCの発現がPD-1阻害療法の効果にどのような影響を及ぼすかを検討しました。その結果、LDHAやMYCの発現量が多い患者は、無増悪生存期間(PFS)が短いことが判明されました。がん患者におけるPD-1阻害療法の効果は、解糖系遺伝子と乳酸代謝系遺伝子の発現により予測可能です。
まとめ
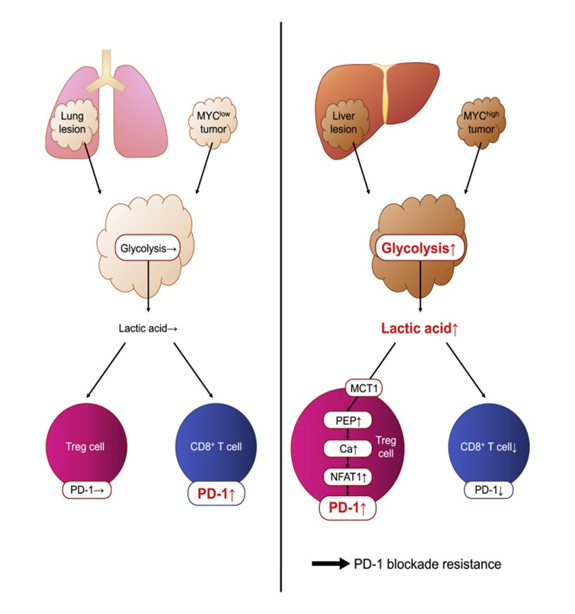
全体として、この研究は、解糖度の高い腫瘍がグルコースを消費して過剰な乳酸を放出し、PD-1の発現とTreg細胞の抑制活性を高め、PD-1阻害治療の無効化につながる一端を示しています。研究者らは、乳酸がTreg細胞に特異的な代謝チェックポイントであることを示唆し、新規免疫療法の開発に「新たなアイデア」を提供するものであるとしています。
