-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
病的な心臓肥大症は十分な治療を受けなければ、心不全を引き起こす。スタミナII(アンチエイジII)が処理した心筋細胞と肥大心臓では、免疫プロテアーゼの活性活性が著しいことがわかった。この作用は、心筋細胞や遺伝子組のラットにβ5iを通って、増幅されたと研究者は伝えた。これは、β5iが心臓肥大化における新たな作用を調節することを示していることから、この活性を抑制することが、心臓肥大化に対する新しい治療法として利用可能である可能性を示している。
5月8日のscience advances雑誌でこの研究成果を発表した。文章の著者は中国の大連医科大学公衆衛生学院の院長李汇華、北京医科大学の王紅霞教授と李教授、心血管疾患(心臓腎不全を含め、心筋梗塞、高血圧や不整脈など)発展の生理病理の発生メカニズムを研究し、主要について汎素たんぱく質の飾り、免疫の炎症や栄養代謝均衡心血管疾患の病理生理调节メカニズム。
心不全はさまざまな心臓病の最後の段階であり、世界的に発病率と死亡率の主な原因の一つとなっている。慢性心不全の2つの特徴は、心臓が大きくて心筋梗塞が進行することと心筋梗塞が減少することである。心臓衰微の前兆として、心臓の肥厚さは、长期的なストレス(慢性的なストレス、神経ホルモンの刺激など)に対する非常に固定的な反応である。
肥大型心筋症は一般に生理的または病的理性的肥大に分けることができる。初期の肥大反応で心の出力量を維持することができる。初期段階での補充後、肥満性の成長が心臓機能の障害を引き起こすと、病理性の肥大とみなされる。
これまで研究結果により、多様な信号を調節できる通路がタンパク質合成心筋肥大と、インスリン様成長因子を含む1受容体(igf1r) /し筋アルコールを3−キナーゼ(pi3k) / akt、表皮成長因子受容体(EGFR) /糸が分裂原—蛋白ナットウキナーゼ(MAPK)の活性化、gp130 / janusナットウキナーゼ(JAK)信号伝達と転写因子(stat3) 3、活性化および活性化のT细胞(NAFT)経路のカルシウム調神経フォスファターゼ/核遺伝子。したがって、これらの受容体への表現、活性化による治療戦略は非常に可能性がある。
プロテオン-プロテアーゼシステム(UPS)と溶解酵素-タンパク分解酵素分解の最も重要な二つの細胞メカニズムです。一般的には非特异性の過程とされ、長い寿命タンパク質と異常タンパク質を解消されます。逆でUPSは真核生物の細胞内でタンパク質が分解する主なルート。標準20Sプロテアーゼには、β1 (PSMB6)、β2 (PSMB7)、β5インターフェロン-γ(IFN-γ)という細胞因子を刺激すると、ベータ1i(免疫亜単位とも呼ばれる):β1i[大部分機能ペプチド酵素2 (LMP2)又はPSMB10)]、ベータ2i (MECL−1又はPSMB10)、β5i (LMP7またはPSMB8)は、標準亜基に代わって20S免疫プロテアーゼを形成する。
免疫プロテアーゼの主な機能は、主要組織の適合性複合体である複合体I (mhc-i)抗原の伝達を改善することだ。免疫プロテアーゼは、炎症を起こす細胞因子の生成、T細胞の分化と生存、酸化ストレスと筋肉の質など多様な生物学的機能を有する。
李教授の研究によると、肥大化した心臓の免疫単位であるベータ5iの表現と、この凝集乳プロテアーゼの活性が著しく増加していることがわかった。このデータによると、β5iは、ラット血管テトラシンII (Ang II)が誘導する心房ビブラートの調整にも関わっている。しかし、β5iは、心臓肥大化を調節する機能はまだ未知である。
この研究ではチームメンバー全員原筋細胞を分析し、β5iノックアウトマウスと心臓の特異β5i遺伝子組換え(ベータ5i−TG)マウス(サイヤジェンは遺伝子組換えマウスサービスを提供)、結果によりβ5iベータ5 iは心臓の肥大発展の新しい役割であるとしてAng iiの心臓を誘導肥大の新型、肥大心臓で免疫タンパク質分解酵素の体を指摘したと)補充する必要がある。
肥大した心臓やHF患者のβ5i表現が増加します
研究者は、損傷した心筋にあるプロテアーゼの表現を検証するために、アンチングIIを通じて野生型(WT)マウスに注入した急性心臓肥大症を誘導し、プロテアーゼ表現をチップ測定法で分析した。
その結果、47個のプロテアーゼ遺伝子のうち免疫亜単位のベータ5i (PSMB8やLMP7とも呼ばれる)が、アンダIIの投与初日、心臓に著しい上昇をみせた。その後、β5imRNAの表現が増大することは、定量的ポリメラーゼ連鎖反応(qPCR)分析によって確認される。
また、Ang IIで処理した心臓では、(PSMB10とも呼ばれる)β2iのmRNAレベルが増加したが、β5iより低いmRNAレベルになる。ただし、Ang IIでは、心臓組織内の基准(β1、β2、β5)と免疫ユニットβ1iの表現には違いがありません。このほか、Ang IIで処理した新生ラット心筋细胞(NRCM)ではベータ5iのレベルが増加した。Ang IIに注注して2周间后、5iの表现はマウスの心臓部にも増加した。Ang IIの刺激後、新生マウスの心臓は繊維細胞としてベータ5i(図1)という表現に変わりはない。
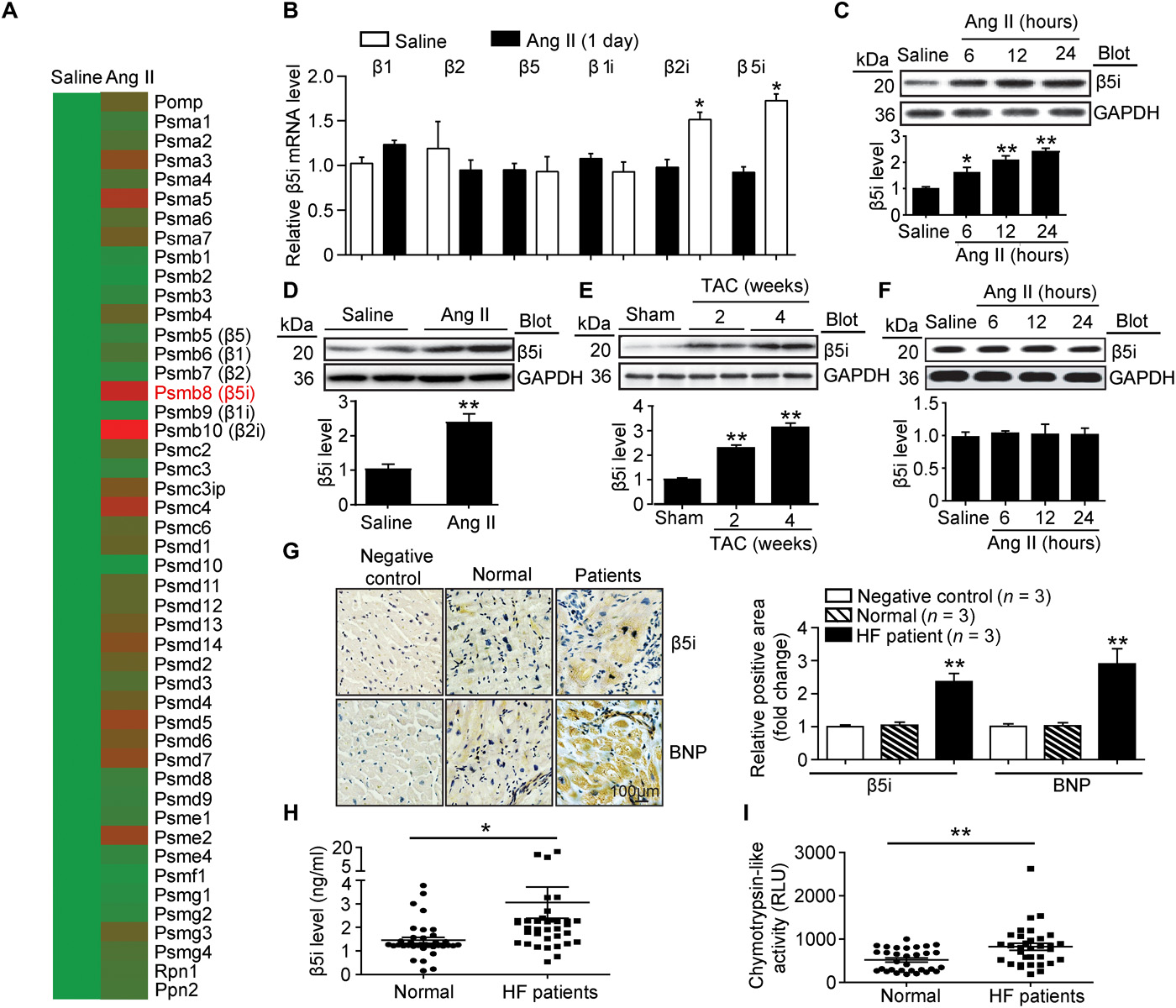
図1
また、人間HFにおいてベータ5iが重要な役割を果たしているかどうかを検査するために、心臓組織におけるベータ5i及びB型ナトリウムペプチド(BNP;HFマーカーの表現免疫組織化学は、陰性心不全心臓におけるβ5iとBNPの表現が正常な対物群を大きく上回っていることを示している。
このほか、HF患者のセロトニンβ5iとトロンプロテアーゼの活性レベルも、対カメラ比で増加します。その後、研究者は、HF患者の血清β5i、または、ジオメトリオンの活性レベルの関係を簡単な交差製図と比較値比(ORs)を用いて分析した。マルチファクタ論理の回帰分析では、セロトニンβ5iまたはトロンプロテアーゼの活性レベルがHFへの独立に貢献することが検出された。これらの結果は、いずれもβ5iが心臓の肥大化を調節する上で重要な役割を果たし得ることを示している。
β5iノックアウトすればベータ5iを打ち込めば、心肥大を体外で抑えることができる
β5iが心臓肥大時の機能に与える影響を調べるため、まずβ5iが体外で肥大化や抗肥大作用を促進するかどうかを調べた。siRNAとは対照的に、β5iを低い値にして、ANF誘導型心筋細胞の大きさの増加を减らし、心房利ナトリウム(ANF)とBNPの表現を示した。
このような発見を確認するため、研究者はさらに研究を行った。Ang−II治療後のad-gfp対応グループと比較すると、ad-β5iのNRCMへの感染は、β5iのレベルを2.3倍にし、心筋細胞のサイズを大きくし、ANFとBNPの表現が増加した。また、β5iのsiRNAは、Ang2による刺激の後のsiRNAと比べて、AKTと細胞外信号調節キナーゼの1/2 (ERK1/2)のリン酸化レベルを低くする。しかし、β5iのノックは、基本的な条件での心筋細胞に影響を与えません。
次に、β5iが、フェニルアドレナリンを処理する心筋細胞に与える影響を分析した。アンネII细胞のデータと一致し、シラナとの比較では、β5iのノイドリン誘導による心筋細胞肥大やANFの表現を减らし、このデータはβ5iを低いと体外で心筋細胞肥大を抑えることができることを示しています。
β5iは、オートファジー仕組みで心筋細胞の大きさを調節する
β5iが、心筋細胞のサイズをオートファジーによって調節するかどうかを判定するため、研究者はsiRNAsで心筋細胞に感染し、内部性β5iとATG5のレベルを下げた。プロテイン解析によると、siRNA−β5iとsiRNA−ATG5はそれぞれ、β5iおよびATG5レベルの低下を実現した。
また、siRNAに比べて、β5iのは、Ang II誘導の心筋細胞のサイズを小さくし、ANF表現およびAKTおよびERK1/2リン酸化の増加を抑え、ATG5またはβ5i、ATG5を低くすることで、完全に逆転することができる。
さらに、オートファジーで心筋細胞のサイズと関連信号の伝達経路に及ぼす影響を実証するため、研究者はsiRNA—β5iで心筋細胞に感染し、クロフルキンゲン(一種の自己催眠剤)となるという。そして、siRNAとの比較では、β5iのノックアウト低さがATG5の表現を増加させ、さらに消费者のクロロキノ処理がこの効果を強めていることを発現しました。siRNA -atg5が細胞に感染したという観察結果と一致し、ベータ5iが低誘電体のAng IIを誘導する心筋細胞の大きさが増加し、ANF表現やAKT、ERK1/2リンの酸化が低下したのも、sirn-β5iが感染した細胞の中でクロロキノと逆転したという。また、クロロキノキノロンだけで、心筋細胞肥大に対するβ5i打低の抑制作用を回復できるという。
いずれにしても、この結果、β5iの活性を断つことは、オートファジーを誘導することで補償を行い、かつオートファジーの抑制がβ5iの低い保護作用に逆転することを示している。
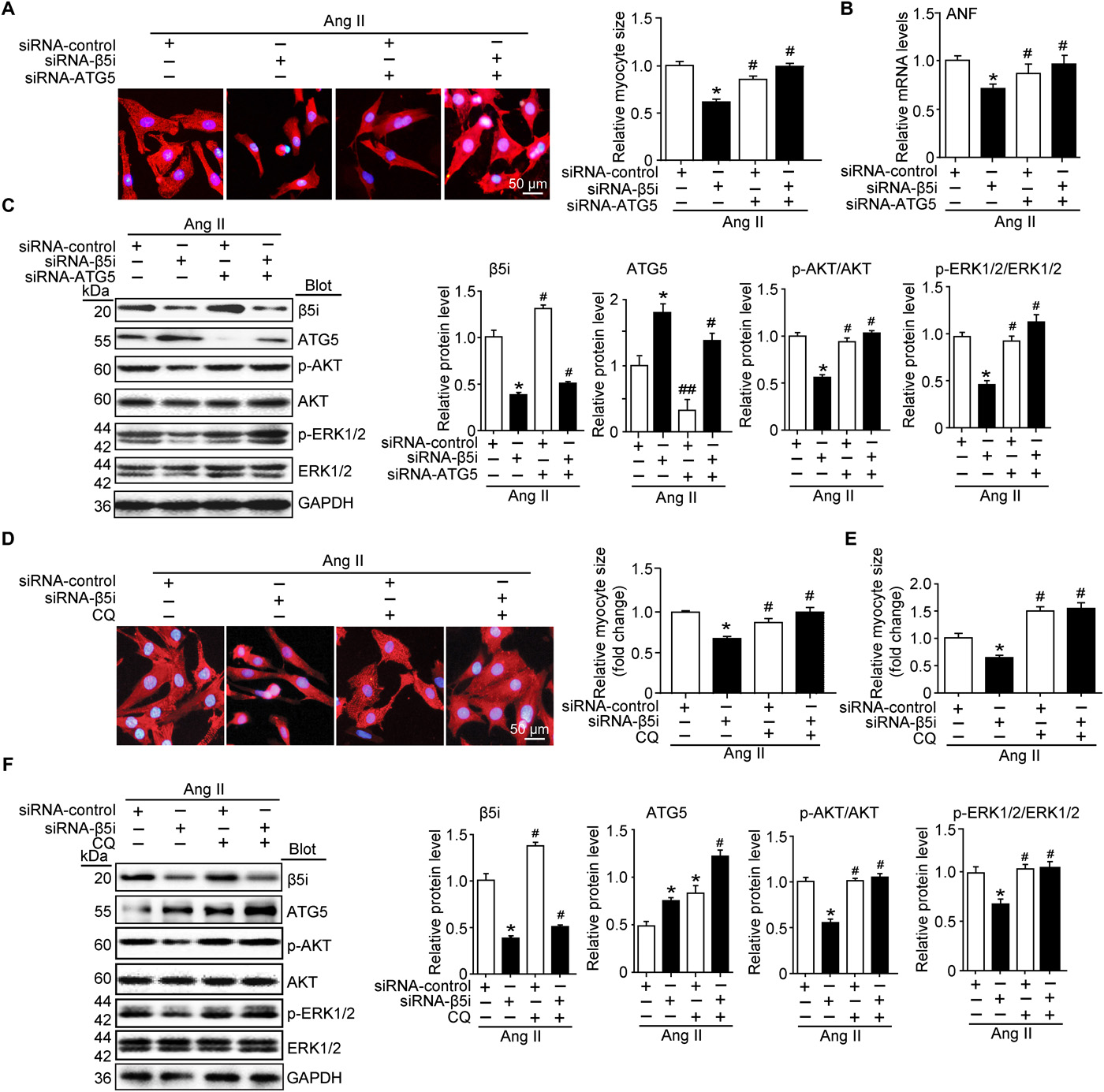
図2
圧力過負荷時は、ATG5ノックアウトすることにより、β5i欠陥マウスの心臓保護作用を相殺する
ATG5依存性を、オートファジーを介在するβ5iの欠乏による心臓肥大への抑制作用をテストするため、研究者はWT又はβ5iKOをラビ9-siRNAで注射し、低ソース性ATG5をはじく。ラバー9-siATG5を注射してから3週間後に、彼らはラバー9-siATG5が心臓中のATG5タンパク質のレベルを著しく低下させていることを発見した。ラバー9-sicontrolに比べ、β5ココは心臓機能が改善した。
このため、ラバー9- sicontrolラットに比べ、β5iKO子鼠のATG5により低感度化したlc-ii /I比lc-iiが、ERK1/2活性化を加えた。TACの後のラバー9- sicontrol動物と比較すると、WTラットの中のATG5が低いのは同様の効果がある。このため、体内データではβ5iKOがATG5のレベルを上げることで、肥大症を弱めることを示しています。
つまり、この研究では免疫亜単位β5iは、生理的な肥厚さの再形成を促進する重要な調整剤としての新しい作用を発見した。このβ5i的な標的は、ATG5により分解され、オートファジーの活性化が抑制されるため、心臓肥大と機能障害を引き起こす。これは免疫プロテアーゼが心臓肥大プログラムとオートファジー化の間に必要な補償関係を示している。
次に、研究チームはE3接続酵素がATG5を活性化するのに重要な要因として、肥大性疾患の治療を可能にする戦略としてベータ5iの抑制を決めた。
著者プロフィール:
李汇華、中国大連医科大学公衆衛生学院長、心血管疾患研究所所長、教育部長江学者特别招聘教授、「中国国家エリート青年科学基金」の受讲者。1998年中国コンコルド医科大学で博士学位を取得し、1998 ~ 2005年にはそれぞれ米国wake forest大学病理学科の米国と北朝鮮のカードが心血管生物学研究センターの博士と研究を補佐し、2005 ~ 2010年、北京コンコルド医学部の病理学科教授を務め、2010 ~ 2014年、首都医科大学の教授を務め、2015−今大連医科大学で働く。ここ数年「国家百万人の人材プロジェクト」に選ばれ、「際立った貢献を行う中青年専門家がいる」、中国華僑界の革新的人材貢献賞、国務院政府特別手当、遼寧省の学者などの栄誉ある称号を受賞した。
研究の方向:
心臓血管の病気(心筋梗塞、心筋梗塞、高血圧及び不整脈などを含む)が進行する病理生理学的メカニズムに関する研究です。セロトニンたんぱく質の修能、免疫炎症及び栄養代謝のアンバランスバランスが心臓血管の病気を調節する病理生理メカニズムについて議論する。
リンク先:
The immunoproteasome catalytic β5i subunit regulates cardiac hypertrophy by targeting the autophagy protein ATG5 for degradation
最新の販売促進キャンペーン:
- Cyagenノックアウトマウスライブラリ:16000種以上のKO/cKO系統マウスを所有、早くて2週間で納品
- 新型コロナウイルス(COVID-19)のワンストップ解決策:特別価格で人気標的ACE2、DPP4、TMPRSS2、CD147などのノックアウト(KO)、ノックイン(KI)及びヒト化マウスモデルを提供致します。
サイヤジェン株式会社について
サイヤジェン株式会社は15年間の発展を経て、すでに全世界の数万人の科学研究者にサービスを提供しており、製品と技術はすでに直接にCNS (Cell、Nature、Science)の定期刊を含む4,300余りの学術論文に応用されています。弊社の「ノックアウトマウスライブラリ」は低価格だけでなく、「遺伝子ID」を検索すれば、ワンクリックで注文まで操作できます。 ノックアウトマウス、ノックインマウス、コンディショナルノックアウトマウス、CRISPR Cas9 ノックアウトマウスのカスタマイズサービスを提供する以外、サイヤジェン株式会社は専門的な手術疾患モデルチームがあり、多種の複雑な小動物手術疾患モデルを提供できます。国際レベルで無菌マウス技術プラットフォームは無菌マウス、無菌動物カスタマイズサービス、微生物移植サービスなどの無菌動物モデルに基づいた各種製品とサービスを提供でき、サイヤジェン株式会社の成熟で安定なトランスジェニックマウスプラットフォームと結合し、遺伝子とフローラの相互作用機序を研究することもできます。
