-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
新型コロナウイルスの起源はまだ確定されていないが、科学界者は各種データから初歩的な解析により、コウモリは新型コロナウイルスの最初の伝播源と考えられている。この論点が正しければ、新型コロナウイルスがコウモリからヒトに移るために体力が不可欠である。全世界の疫病の状況により、新型コロナウイルスの変化は人類に体力消耗していくのではなく、常に変異している。本文を通じて、コウモリから人類まで新型コロナウイルスは何を経験したのか検討しようと考えています。なぜ人間の世界でこんなに手強いのか。最後に終息可能なのか。
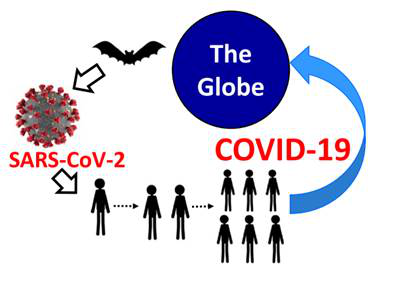
Fig 1. 新型コロナウイルスがコウモリから人類に
(参考文献: Thamina Acter et al. 2020)
1. コロナウイルスの多様性の分析につき
周知のように、コウモリは空を飛べる唯一の哺乳類であり、持っているウイルスは幾千万である。種の壁を越えて人類に伝播し、いろんな重大な病気を引き起こす恐れがある。SARS、MERS、Ebola及び今流行している新型コロナウイルスが含まれる。まず新型コロナウイルスにつき分析します。
新型コロナウイルスはコロナウイルス属に分類され、その進化は規則的である。SARSとMERSのコロナウイルスが流行した時に、学者が次々とコロナウイルスを研究してきたが、SARSの爆発と収束とも早いため、多くの当該ウイルスに対する研究に関するプロジェクトが中止された。また、MERSが中国民衆の生命を直接に脅かしなかったため、コロナウイルスに対する認識はさらに深くなっていなかった。2020年1月に新型コロナが発生した後、学者は観望から疫病に対する正確な判断を得るまで、新型コロナウイルスとは一体何かを大衆に知らせた。以下のように科学的視点から、コロナウイルスの起源と進化を探究し、コロナウイルスの多様性を分析します。
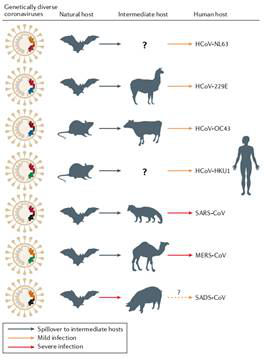
Fig 2. 人類コロナウイルスの動物由来
(参考文献: Jie Cui et al. 2019)
中国の武漢ウイルス研究所の石氏はNature Reviewで「Origin and evolution of pathogenic coronaviruses」という文章を発表され、コロナウイルスの起源と進化を論じた。文章はSARSとMERSのコロナウイルスの発病と致命性の強さの原因を論じ、コウモリコロナウイルスの多様性と異種伝播の可能性を強調し、進化の観点からコロナウイルスシステムの発育の関係を分析し、SARSコロナウイルスが種を越え、人類に感染する経路を把握した。ドラマチックなのは、この文章は2019年3月に発表された。その時、新型コロナは発生していなかった。文章はコロナウイルスの分類及び各種のコロナウイルスシーケンスの多様性を解析し、2019年末に発生した新型コロナに関する調査に良い理論根拠を提供した。
ウイルスの異種伝播は容易ではない。コウモリは冬に洞窟で生息している。この2つ原因はウイルスは種を超えて感染することを実現するには、きっと1種あるいは多種の中間宿主の存在があることを提示させた。それで、ウイルスの種の間の存在形式は同じなのか。そうではない。図3はコロナウイルスがシーケンス多様性を有していることを示している。
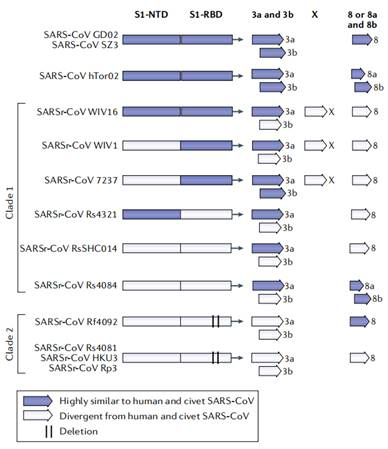
Fig 3. コロナウイルスのシーケンス多様性
(参考文献: Jie Cui et al. 2019)
研究が進むにつれて、2020年3月中国の北京大学生科院研究チームはNational Science Reviewで「On the origin and continuing evolution of SARS-CoV-2」という文章を発表され、類似な観点を証明された。文章は新型コロナウイルスと他のコロナウイルスとの分子差異を探究し、ゲノムヌクレオチドの違いから分析し、機能タンパク質の各構造ユニットと複数の類似なコロナウイルスを比較し、コロナウイルスに関するシステム分子発育樹を解析し、構造的に新型コロナウイルスの可能な変異方式を分析した。最後にコウモリRaTG13のコロナウイルスと新型コロナウイルスの間に差異がわずか4%あることを発見した。
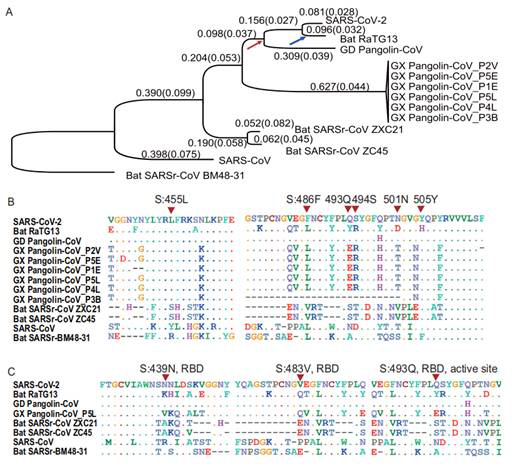
Fig 4. コロナウイルスの進化過程における分子発育と選択圧力
(参考文献: Xiaolu Tang et al. 2020)
以上はウイルス進化システムの発育とウイルス機能分子システムの発育の観点から、新型コロナウイルスの可能な起源とコロナウイルスの多様性を述べ、ウイルスが種を超えて人類に感染するのに、その独自の進化優勢が必要であることを説明している。それでは、主導的な地位を占めている新型コロナウイルスSタンパク質は何か言いたいことがあるか。
2. 新型コロナウイルスSタンパク質の鍵となる残基数が種間における差異
文献調査を通じ、分析を続けていくと、新型コロナウイルスと異なる種を感染するSARSウイルスとの間に一つの現象がある。それは以下のように、ウイルスSタンパク質RBM残基の重要な部位に差異がある。これらの自然進化の過程で選別された5つの重要な残基は新型コロナウイルスが生存できる進化の優位であり、異なる種の感染表現型の差異を引き起こす重要な原因の一つである。研究はこの5つの残基は宿主受容体ACE2がウイルスを識別し、ウイルスが宿主細胞に侵入する過程で重要な役割を果たしていることを証明した。
表1. 2019-nCoVとSARS-CoVのRBMキー残基の異なる種間の差異
(参考文献: Yushun Wan et al. 2020)
この進化力はウイルスを絶え間なく動物に乗り越えらせていく。その長期的な生存と発展を求める方法は自分自身を変える以外に、自身のエネルギーを減らすためにもっと多くの外部の力を借りる必要である。例えば、新型コロナウイルスが異種伝播を実現するには必ず有効な媒介が必要である。下記に重要な宿主媒介ACE2受容体タンパクの種間での差異を検討することで、新型コロナウイルスが最終的に人体に寄生するのは一挙に成し遂げることではない。自分を絶え間なく進化させ、受容体などを改変する長い過程で実現した。
3. 新型コロナウイルスの主要な受容体ACE2の種間の差異
動物により、新型コロナウイルスに感染する表現型が違っている。ある動物が感染しやすく、ある動物が感染しにくい。なぜこのようになるのか。
まずデータを見てみよう。SARSの爆発から2015年まで、米国国立衛生研究院がSARSウイルスに対して、異なる種の動物モデルの感染試験を行ったところ、近交系マウスで作ったウイルス感染マウスモデルは異なった表現型を持っていることを発見した。しかし、全体的にウイルスに感染しにくい。シリアハムスターモデルでSARSコロナウイルスの異なる毒株感染試験を行いったところ、FrK-1毒株の感染がハムスターの有限な死亡を招くことを発見した;フェレットモデルは明らかに人類がSARSウイルスに感染した症状と似た症状を示した;非霊長類の哺乳動物、例えば、アフリカミドリザル、カニクイザル、アカゲザルなど、明らかな致命的な現象が発見されなかった。その後、研究者も新型コロナウイルスを研究して、類似な現象を発見した。これは新型コロナウイルスに感染した各種動物が現れる表現型が、ヒトが新型コロナ肺炎に感染した症状及び他の症状と異なることを示している。主な原因は新型コロナウイルスの主要な受容体ACE2の種間の差異から考える必要である。
ACE2タンパク質はSARS及び新型コロナウイルスの主要な受容体であると知っている。ACE2の立体配座変化またはアミノ酸の違いがウイルスとの結合能力の違いを引き起こす。米国ミネソタ大学獣医学院及び生物医学科学系チームは共同に「Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade-Long Structural Studies of SARS Coronavirus」を発表された。データ分析を通して、異なる種のACE2がウイルスと結合する鍵となる残基は下表に示すように差異がある。
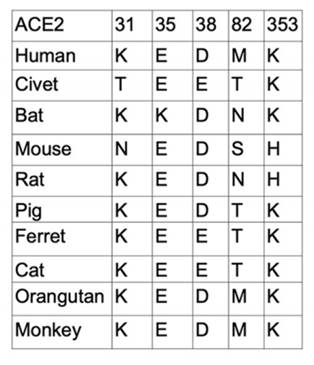
表2. 異なる宿主ACE2の重要な残基の差異比較
(参考文献:Yushun Wan et al. 2020)
ACE2の立体配座の変化或いは重要な残基の違いがウイルスとの結合能力の違いを引き起こす。これはなぜ異なる種が新型コロナウイルスに感染された後に異なる感染特徴が表れるか明らかにした。
以上のように、新型コロナウイルスは異なる種の間の違いが分かった。ウイルスは進化の過程でアミノ酸の突然変異、配列の再編成があり、ウイルスの構造がもっと複雑になる。同時に、新型コロナウイルスの主要な宿主受容体は種間で差異があり、これは各種のウイルスに対する感染性、親和力、発病及び致命性の違いをもたらした。
まとめ
ウイルスの属間の違いを知ることで、ウイルスの進化過程と進化の方向をもっとよく知ることができる。これもウイルスがコウモリから人間にジャンプするための重要な過程である。ウイルスは生存のために、適切な宿主を探し続け、複雑な機体環境に適応し、最後に人類に生存のきっかけを発見した。もちろん、寄生性物質として、ウイルスの目的が人間を殺すことではなく、人間にその存在を目覚めさせ、生物と共存するための最良の生き方を得ることである。最後に、皆様の注目している問題に答える:新型コロナウイルスは消えるか。以上の理論知識が分かったら、この問題はもう気にしなくてもいいと思う。新型コロナウイルスが消えないなら、我々は自身から変えて、体の素質を強めて、予防措置をしっかりと行う。新型コロナウイルスが消えたら、私達は依然としてもっと多くの新型ウイルスの出現に対応するために準備を整える。
新型コロナウイルスの感染経緯を知った後、我々が行う必要なのは、良い予防システムを作って人類の高品質の生存状態を維持することである。新型コロナでも未来に発生する可能性のあるウイルスでも、ウイルスの出現と可能性のある変異に備える必要である。そのため、モデル動物の応用は極めて重要に見える。動物モデルを通して人間がウイルスに感染した症状をシミュレーションし、ワクチンや抗ウイルス薬を開発し、人類の健康に保障を提供する。次回は様々なマウス系統が新型コロナウイルスに感染した後にどのような表現型を現れるか、弊社が設計したコロナマウスモデルのメリットは何か詳しくお話しさせていただきます。ご興味をお持ちいただけましたら幸いです。
参考文献:
1.Xiaolu Tang, Changcheng Wu, Xiang Li et al. On the origin and continuing evolution of SARS-CoV-2. National Science Review. 2020. https://doi.org/10.1093/nsr/nwaa036
2.Jie Cui, Fang Li and Zheng-Li Shi. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol 17, 181–192 (2019). https://doi.org/10.1038/s41579-018-0118-9
3.Jan Felix Drexler, Victor Max Corman, Christian Drosten. Ecology, evolution and classification of bat coronaciruses in the aftermath of SARS. Antiviral Research. 2014;101:45-56. DOI:10.1016/j.antiviral.2013.10.013
4.Troy C Sutton and Kanta Subbarao. Development of Animal Models Against Emerging Coronaviruses: From SARS to MERS coronavirus. Virology. 2015;479-480:247-258. DOI:10.1016/j.virol.2015.02.030
5.Lisa M Gretebeck and Kanta Subbarao. Animal models for SARS and MERS coronaviruses. Current Opinion in Virology. 2015;13:123-129. DOI:10.1016/j.coviro.2015.06.009
6.Fang Li. Receptor recognition and cross-species infections of SARS coronavirus. Antiviral Research. 2013;100(1):246-254. DOI:10.1016/j.antiviral.2013.08.014
7.Chun Li, Yanling Yang, Linzhu Ren. Genetic evolution analysis of 2019 novel coronavirus and coronavirus from other species. Infection, Genetics and Evolution. 2020. https://doi.org/10.1016/j.meegid.2020.104285
8.Fang Li, Wenhui Li, Michael Farzan, Stephen C. Harrison. Structure of SARS Coronavirus spike receptor-binding domain complexed with receptor. Science. 2005;309(5742):1864-1868. DOI:10.1126/science.1116480
9.Yushun Wan, Jian Shang, Rachel Graham, Ralph S. Baric, Fang Li. Receptor recognition by the novel coronavirus from Wuhan: an analysis based on decade-long sturctural studies of SARS coronavirus. Journal of Virology. 2020. 94 (7) e00127-20; DOI: 10.1128/JVI.00127-20
10.Thamina Acter, Nizam Uddin, Jagotamoy Das et al. Evolution of severe acute respiratory syndrome coronavirus 2 as coronavirus disease 2019 (COVID-19) pandemic: A global health emergency. Science of the Total Environment. 2020. DOI: 730. 10.1016/j.scitotenv.2020.138996.
最新の販売促進キャンペーン:
- Cyagenノックアウトマウスライブラリ:16000種以上のKO/cKO系統マウス、3000種以上の生体マウス品系を所有、早くて2週間で納品
- KAKEN申請支援-cKOマウスは今なら180万円で、更に10万円のプレゼント券を用意致します
- Creラットの無料試用:Creモデルライブラリを設立していて、各種のラット品系が含まれます
サイヤジェン株式会社について
サイヤジェン株式会社は15年間の発展を経て、全世界の数万人の科学研究者にサービスを提供しており、製品と技術は直接にCNS (Cell、Nature、Science)の定期刊を含む5,200余りの学術論文に応用されています。弊社の「ノックアウトマウスライブラリ」は低価格だけでなく、遺伝子名称を入力すれば、ワンクリックで注文まで操作できます。 ノックアウトマウス、ノックインマウス、コンディショナルノックアウトマウス、トランスジェニックマウス、GFPマウス、免疫不全マウス、無菌マウスなどのカスタマイズサービスを提供する以外、専門的な手術疾患モデルチームがあり、多種の複雑な小動物手術疾患モデルも提供できます。
