-
サイヤジェンニュースお申し込み サブスクライブすると、研究動向とキャンペーンを取得いただけます。
-
お問合せフォーム
適切な動物モデルを作製することは基礎医学研究において非常に重要な研究方法であり、ラットとマウスは基礎研究における不可欠である。体が小さく、コストが低く、特に胚細胞が比較的に安定しており、各種の遺伝子操作と遺伝子編集をしやすいという長所があり、マウスが人類の遺伝子機能を解析する最も重要なモデル生物になる。しかし、マウスと比べ、ラットは生理的特徴、形態と遺伝子が人類にもっと近い。同時に、ラットは大きい体と臓器があり、数回のサンプリング、及び体内の電気生理学、神経外科と神経影像学のプログラム操作を行いやすい。そのため、ラットは毒理学、奇形学、内分泌学、腫瘍学、神経病学、実験老年学、心血管、歯科と実験寄生虫学等の研究にもっと適切である。
詳細については、写真をクリックしてください
次に、ラットとマウスの違いにつきお話します。これらの違いはどのような研究分野でラットが適用されるか?どのようにラットの優位性を最大化し研究を行うか?
1.ラットとマウスは主にどんな違いがあるか?
まず人類との類似性において、ラット、マウスと人類との進化の違いは小さいが、ラットはある方面で人類にもっと近い。例えば、マウスの心拍数は600 bpmに達することができる。ラットは300 bpmぐらいに下がり、人類の70 bpmにもっと近い。ゲノムから見ると、マウスは26億組で、ラットは27.5億組で人類の29億組にもっと近い。染色体はラットが20組で、ラットと人類はそれぞれ21組と23組である。
SDラットとC57マウスは生物医学研究(特に神経生物学研究)で最も一般的なラットとマウスである。最近の研究で、遺伝子チップに基づいて分析して検測できた10,833遺伝子のうち、4,713遺伝子がラットとマウスの海馬ニューロンの突起に発現の違いがあることがわかった。同じ遺伝子チップ技術を使って海馬ニューロンを研究したところ、54遺伝子だけがC57BL/6とBalb/cの2つの最もよく使われているマウスの品系の間に発現の違いがある。海馬体の行動(特に学習記憶)における重要性を考慮して、この発見はラットとマウスとの行動の違いをよく説明した。同様に、研究者もラットとマウスとの他の組織(心臓、骨格筋、腸などを含む)を比較した。これらの組織の違いも大きいが、海馬体の違いほど大きくない。しかし、これはラットとマウスとの間の実験結果の違いに注意するには十分である。ラットとマウスとの間の最も明らかな違いの一つは大きさと体重である。成年ラットの体重は大体成年マウスの8~10倍である。体型の方面が科学研究に与えた影響は利益もあれば弊害もある。
2.どの研究分野でラットがもっと適用されるか?
1)ラットは心血管疾患を研究する優れたモデルであり、特に脳卒中と高血圧である。また、多種類の品系のラットモデルはこれらの研究の理想的な対象となった。
2)ラットの乳がんモデルは組織病理学にホルモン反応があり、もっと人類の病気に近い前癌段階を持っているので、マウスモデルより優れている。
3)ラットは人類の生殖力学研究の主要なモデルである。
4)糖尿病モデルで、ラットモデルは環境要因(毒素、ストレス、飲食とワクチン接種など)によって病気を変える能力を含むある重要な方面で人類により近い。
5)神経変性疾患について、Pink1とDJ-1をノックアウトしたラットは8ヵ月齢の時に中脳黒質ドーパミンニューロンの50%以上の損失を示している。マウスの表現型が明らかでないことより、ラット遺伝子編集モデルがパーキンソン病を治療する希望をもっと多く与えた。これは初めて遺伝子編集動物モデルでドーパミンニューロンの損失を発見した。また、これらのラットは運動ニューロン機能を検出する行動学実験にも症状を示した。
6)マウスは行動学的整合性が悪く、通常各グループの数がラットの1.5倍の時に統計して得た結果が比較的に信頼できる。ラットはマウスより賢く、学習記憶実験でもっと良い表現を示している。そのため、薬物に対する影響ももっとはっきりしている。疼痛研究で、ラットはマウスの中でよく見られる不安による痛みのしびれが出現し難い。実際に、痛覚関連の文献の数では、ラットがマウスに負けたことがない。
7)過去の前臨床研究でマウスの実験で薬物の有効性を検証した後、またラットで安全性を検証してから臨床の人体安全性試験を行う必要である。これはラットの安全性データが豊富で参考性が高い。ラットの遺伝子編集が成熟すると、ラットに直接的かつ同時に有効性と安全性を検査でき、時間が節約できる。
8)ラットの大きい体型は多くの実際的な利点を与える。特に外科手術と脊髄損傷の研究において、ラットモデルはこの点で大きな転化価値を持っている。また、臓器組織イメージング研究でもマウスより優位に立っている。
近年、医療科学研究分野で、前臨床試験から臨床転化までの過程で、多くのマウスに基づいた研究が失敗に終わった。これは人類の病気にもっと関連する動物モデルが必要かどうか、考えなければならない。その背景に、科学者たちは再度ラットに目を向けた。新たなモデル動物を開発するのに膨大な時間と資金を投入することより、ラットは人類の「旧友」と認められる。また、ラットの遺伝子編集時代における潜在力はまだ十分に開発されていない。
3.どのようにラットの優位性を最大限に発揮して研究するか?
ラット胚胎への制御能力の増強及びCRISPR/Cas9技術の導入に伴い、ラットは実験モデル動物として、基礎研究や薬剤スクリーニング、前臨床薬物評価での応用範囲が拡大された。しかし、最も重要な遺伝子コンディショナル発現方案として、Cre-LoxPシステムでラットの種類はマウスよりずっと少ない。これはラットへの応用をひどく妨害している。Cre-LoxPシステムはマウスへの応用がかなり広く、多くの遺伝子は対応のLoxPマウスがある。また、特異性プロモーターのCreマウス資源もかなり豊富である。但し、ラットで、遺伝子編集技術の発達が遅れているため、現在LoxPラットも、組織特異性のプロモーターにつながるCreラットも、その種類はマウスよりずっと低い。サイヤジェン株式会社は過剰排卵ラットの低い胚胎受精率と高い胚胎奇形率、卵細胞品系と個体との間の大きい差異、より厚くて弾力のある核膜と細胞膜による注射困難等のいくつかの難点に対して、生産過程の各部分を最適化し、幾つかの技術難関を突破し、もっと複雑なコンディショナルノックアウトラットモデルの作製を実現できます。サイヤジェン株式会社はノックアウト、点突然変異、ノックイン等の多種の遺伝子編集ラットサービスを提供します。SD、Wistar、Long Evans、F344、Brown Norwayラットなどの様々な品系の選択も提供し、研究者様のためにもっと良いラットモデルの作製に力を尽くします。
サイヤジェン株式会社はCreモデルライブラリの設立に取り組んでおり、その中に各種のラットとマウスの品系が含まれ、全世界の研究者様に供します。
既存のCreラット品系は以下の通りです。
| alb(Cre Ert2) | myh6(Cre Ert2) | slc6a3(Cre Ert2) | camk2a(Cre Ert2) |
| alb(Cre) | myh6(Cre) | slc6a3(Cre) | camk2a(Cre) |
| gfap(Cre) | nes(Cre) | nphs2(Cre Ert2) | |
| gfap(Cre Ert2) | nes(Cre Ert2) | nphs2(Cre) |
コメント:表示されるCreラットモデルの以外、他の品系のラットモデルが必要なら、[email protected]でお問い合わせください。カスタマイズ見積もりをご取得いただけます。
Creラットはコンディショナル遺伝子編集動物を得るのにLoxPラットと交配して1~2世代を経る必要があることを考慮し、また、Cre酵素に効率とある程度の漏れの問題があり、研究の進捗に影響を与える可能性に呼応して、ウイルス誘導のラット遺伝子の過剰発現・ノックアウト・ノックイン・点突然変異が出てきた。
現在主に使われているウイルス発現システムはアデノウイルス(Adeno)、レンチウイルスと腺関連ウイルスの三種類がある。これらのウイルスシステムはそれぞれ長所と短所がある。
1)アデノウイルスの長所は発現効率が高く、発現開始時間が早く、パッケージできるDNA断片は相対的に一番大きいが、強い免疫原性と毒性がある。一般的にインビトロー細胞のトランスフェクションに適している。生体に使うと動物の死亡率が高く、実験ウィンドウ期が短い。
2)レンチウイルスはDNAに逆転写され、宿主遺伝子に永久的に統合されるので、目的遺伝子は長期的で安定的に発現できる。レンチウイルスは最も一般的な遺伝子伝達ウイルスシステムであり、アデノウイルスよりもずっと小さい免疫原性を持っている。生体トランスフェクションとしても使えるが、力価も効率も免疫原性ももっと優れている腺関連ウイルスと比較してみると見劣りがする。
3)腺関連ウイルスの最大の利点は極めて低い免疫原性を持っているので、宿主と長期的に共存できることを最大可能に保証することにある。生物安全性も高く、生物安全等級が低い実験室で実験を行うことができる。様々な種類の血清型は異なる組織への親和度が違っているため、全身注射の場合でも強い組織特異性を持ち、ポジションニング注射で補助すれば、実験の組織細胞精度を大幅に向上できる。生体実験に最適なツールウイルスであるが、クローン容量が足りないという問題もある。
| アデノウイルス | レンチウイルス | 腺関連ウイルス | |
| ウイルスゲノム | 二本鎖DNA | 一本鎖(RNA+) | 一本鎖DNA |
| カプシド | 無い | 有る | 無い |
| 複製 | 自己複製 | 自己複製 | 非自己複製 |
| 統合するか | 無し | 無し | どちらでもいい |
| 感染の細胞タイプ | 分裂&非分裂 | 分裂&非分裂 | 分裂&非分裂 |
| 発現豊度 | 高い | 一般 | 少し高い |
| 発現の開始時間 | 早い(1-2日間) | 少し早い(2-4日間) | 遅い(1-2週間) |
| 発現の継続時間 | 短い | 長い | 長い |
| 力価 | 高い | 一般 | 少し高い |
| クローン容量 | 8k以下 | 8k以下 | 4k以下 |
| 転化効率 | 高い | 一般 | 一般 |
| 免疫原性 | 高い | 少し低い | 非常に低い |
図1. 3つの有触れたウイルスベクターの比較
3つのツールウイルスの長所と短所を総合すると、CreまたはLoxP動物との併用において、AAVの介する組織特異性発現は他の2つのウイルスシステムに比べてもっと良い効果を持っている。

図2. 異なるAAVの組織特異性
AAVはこれらの長所がある、CreまたはLoxPラットとの配合に大いに異彩を放つことができる。LoxPとCreラットが多く開発されているが、このプロセスは一挙に成し遂げることはできないからである。ラットのCre酵素の効率とリークの可能性を考慮し、開発時間が長くなる可能性がある。したがって、現在の最善策はCreとLoxPラットを開発するとともに、AAVウイルスを利用して既存のラットに対して組織特異的な操作を先行に行うことである。ウイルスベクターの構築時間は常に動物を実験に使える数まで繁殖する時間よりずっと短い。この方法を使用して動物の表現型を早く研究して検証し、次の研究戦略と方向を早く決定し、研究者様の貴重な時間を節約することができる。
注意を要するのは、AAV注射による特異性発現はただ時間を節約する「一時しのぎ」ではない。生命科学研究における体内実験の不確実性と現在開発された益々豊富な研究手段のため、研究結果が認められるようになるには、様々な方法の交差検証も自分の論文の品質に分銅を増やすことができる。
また、Cre-LoxP動物は遺伝子に対する空間特異性の研究において成熟しているが、ノックインした複数のプロモーターが多数の組織で同時に発現する場合もある。この場合、もし我々の焦点が一つの組織のみなら、他の組織でのCreの発現はまだ研究精度に影響を与える。AAVのポジショニング注射はこの問題をうまく解決できる。我々は自分の研究したい組織にウイルスを注射するだけでいい。区域特異性が非常に強い。
手元の遺伝子編集マウスをさらに利用するために、AAV注射の方案は二つに分けられる。一つは手元にLoxPラットがあれば、AAVパッケージ組織特異性のCreを注射することである。逆に、手元にCreラットがあれば、逆に接続端にLoxP部位がある目的遺伝子や他の要素をパッケージしたウイルスを注射できる。組織特異性Creに対してAAVパッケージを行うのが一般的である。
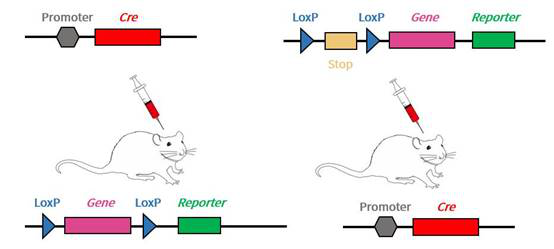
図3. AAVウイルスパッケージDNAとマウスを組み合わせて条件付き発現を行う
AAVの介するコンディショナル編集は上記の多くの長所を持っているが、利益のあるところには弊害もある。AAV注射の短所はまずそのパッケージ断片が短いことである。大きな断片がこの方法を採用できなく、その適用範囲が制限される。レポーター遺伝子などの付属遺伝子で取捨を決定しなければならない。Cre遺伝子の前のプロモーターの選択も制限される。もう一つは時間と資金を含む学習コストがある。特に脳部の注射で、異なる区域に正確に注射する必要である。元々マウスの脳は大きくない。また、年齢、性別、品系、成長史などの原因で、全ての動物が図鑑のようにならないので、正確に位置を把握するのに工夫が必要である。ウイルスは外来のもので、細胞自身由来のものではない。そのため、注射部位の濃度が不均一になることがあり、実験結果に影響を与える。注射の中心部のウイルスの含有量は周辺より高いことは間違いない。最後はコストの問題である。ほとんどの場合、AAVを使用して条件付きで発現するコストはCre-LoxPマウスより低いが、二つの例外がある。まず、全身性注射を採用すれば、ウイルスの消費量も非常に大きい。また、ウイルス注射動物の数が増えるにつれて、ウイルスの費用は線形増加すると言える。交配でラットを作製する方案は違っている。前期の投入や動物の飼育は大量の経費がかかるが、一たび品質システムの構築が成功した暁には、意外なことがなければ継続的に使用できる。後期の費用は普通の動物飼育費用で、逓減する状態である。
要するに、2つの方法の利害を十分に考慮してから決定しないと遣い熟せない。条件が許す限り、AAV補助のコンディショナルノックアウト動物と伝統的なCre-LoxP動物は相補性があり、またお互いに検証できる。ラットは自身の優勢を加えて、代謝、心血管と神経などの方面で無限の潜在力を持っていて、これらの疾患にもっと完璧なモデルを提供し、生物医薬研究に不可欠な助力となる。
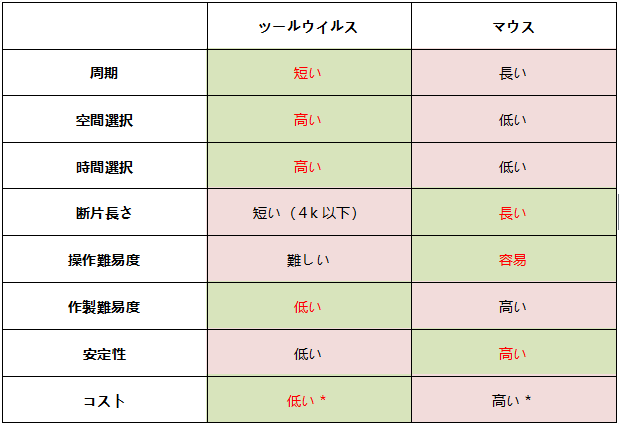
図4. ウイルスとコンディショナルノックアウト動物の比較
参考文献:
1. Dietrich, M.R., R.A. Ankeny, and P.M. Chen, Publication trends in model organism research. Genetics, 2014. 198(3): p. 787-94.
2. Haery, L., et al., Adeno-Associated Virus Technologies and Methods for Targeted Neuronal Manipulation. Front Neuroanat, 2019. 13: p. 93.
3. Tsien, J.Z., Cre-Lox Neurogenetics: 20 Years of Versatile Applications in Brain Research and Counting. Front Genet, 2016. 7: p. 19.
4. Meek, S., T. Mashimo, and T. Burdon, From engineering to editing the rat genome. Mamm Genome, 2017. 28(7-8): p. 302-314.
5. Balakrishnan, B. and G.R. Jayandharan, Basic biology of adeno-associated virus (AAV) vectors used in gene therapy. Curr Gene Ther, 2014. 14(2): p. 86-100.
6. Kim, H., et al., Mouse Cre-LoxP system: general principles to determine tissue-specific roles of target genes. Lab Anim Res, 2018. 34(4): p. 147-159.
最新の販売促進キャンペーン:
- Cyagenノックアウトマウスライブラリ:16000種以上のKO/cKO系統マウスを所有、早くて2週間で納品
- ACE2ヒト化マウス:SARS-CoV-2のワクチン開発と薬物スクリーニングに取り組む
- BACターゲット技術-大きな断片のヒト化マウス:新薬の開発はこれを選びましょう
サイヤジェン株式会社について
サイヤジェン株式会社は15年間の発展を経て、全世界の数万人の科学研究者にサービスを提供しており、製品と技術は直接にCNS (Cell、Nature、Science)の定期刊を含む5,200余りの学術論文に応用されています。弊社の「ノックアウトマウスライブラリ」は低価格だけでなく、遺伝子名称を入力すれば、ワンクリックで注文まで操作できます。 ノックアウトマウス、ノックインマウス、コンディショナルノックアウトマウス、トランスジェニックマウス、GFPマウス、免疫不全マウス、無菌マウスなどのカスタマイズサービスを提供する以外、専門的な手術疾患モデルチームがあり、多種の複雑な小動物手術疾患モデルも提供できます。

